M. Duca*,Roberto Menicagli^
*Ospedale Bassini, Milano
^Romabiomedresearch Mediglia, Milano
Abstract
Secondo l’American European Consensus Group (AECG) si effettua diagnosi di sindrome di Sjogren primaria (pSS) rilevando, la presenza di un segno oculare, di uno salivare, la comparsa nel siero di autoanticorpi specifici e/o positività all’esame istopatologico delle ghiandole salivari. Di fatto, per la mancanza negli ambulatori pubblici, delle strutture di analisi sierologiche e/o istologiche, è impossibile effettuare la diagnosi in un solo giorno. Scopo dello studio è diagnosticare la (pSS), in queste strutture, mediante un iter diagnostico integrante le visite oculistiche e otorinolaringoiatriche, contemporaneamente alla ricerca degli anticorpi anti-Ro(SSA),anti-La(SSA) nella saliva dei pazienti, da parte dello specialista otorinolaringoiatra.
Materiali e Metodi. Venticinque su circa settemila pazienti, in visita otorinolaringoiatrica e/o oculistica presentavano sospetta anamnesi di (pSS). Su questi, è stata effettuata la prova di flusso salivare, la ricerca degli autoanticorpi ANA/ENA nella saliva con Immuno Blot, la visita oculistica con effettuazione dello Schirmer test. Il criterio di diagnosi è quello indicato dalla (AECG).
Risultati: Quattro pazienti sono risultati positivi ai test di Schirmer e del flusso salivare e nella saliva erano presenti gli anti-Ro(SSA), e secondo il protocollo (AECG), affetti (pSS). Due pazienti positivi per anti-Ro(SSA), SmD1 e PO, presentano una probabile Sjogren secondaria, mentre per un altro positivo per Istoni si sospetta LES. Per un ‘altro paziente si è ricorso all’esame istopatologico per confermare la diagnosi di pSS, poiché essa non era possibile con questo iter diagnostico avendo riscontrato anti-RoSSA, ma positività solo al flusso salivare. La sensibilità dell’iter diagnostico è uguale al 80 % I dati ricavati indicano una prevalenza della SS di 7.2 /10000 pazienti.
Conclusioni: Questa ricerca, impiegando le competenze ambulatoriali propone un nuovo integrato iter diagnostico per la diagnosi della pSS secondo i criteri (AECG),e ripropone la questione della SS “malattia rara”.
INTRODUZIONE
La sindrome di Sjogren primaria (pSS), o sindrome Sicca (1), è una malattia infiammatoria cronica, caratterizzata da secchezza degli occhi (xeroftalmia) e della bocca (xerostomia), a patogenesi autoimmune, dovuta a una riduzione della secrezione delle ghiandole lacrimali e salivari. La SS può anche essere secondaria, in associazione ad altre patologie autoimmuni come l’artrite reumatoide, il lupus eritematoso sistemico e la sclerosi sistemica progressiva. La pSS può accompagnarsi a un’infiltrazione linfocitaria di differenti organi e tessuti e può portare a nefrite e/o polmonite interstiziale ed è associata ad un aumentato rischio di sviluppare patologie linfoproliferative. L’eziopatogenesi della pSS è ancora tutta da chiarire e probabilmente multifattoriale ovvero, genetica e ambientale. L’importanza dei fattori genetici secondo i più recenti studi, è confermata dall’associazione tra pSS e alcuni fenotipi del HLA (2), in particolare per i geni presenti: nella regione D sottoregione DR, codificanti antigeni HLA di classe 2, ovvero:
- DRW52
- DR3: forma associata ad anticorpi anti-SSA e -SSB
- DR4: forma associata ad artrite reumatoide
Recentemente sempre più studi evidenziano anche altre possibili influenze genetiche, principalmente con il lavoro svolto dal team che è stato in grado di identificare sei nuovi geni probabilmente associati alla SS. Il team internazionale di ricercatori fa parte del progetto SGENE ed ha identificato questi geni correlati alla malattia (3.) , che sono:
- IRF5 e STAT4 che sono “regolatori master” che attivano le cellule durante una risposta immunitaria;
- CXCR5 controlla il turn-over dei linfociti e può aiutare a spiegare il motivo per cui le cellule immunitarie bersaglio ghiandole produttrici di umidità;
- TNIP1 è un partner di legame con un altro gene di codifica di autoimmunità correlato alla malattia;
- TNFAIP3, che “taglia” i meccanismi di autoregolazione sul sistema immunitario.
- IL12A è una sub-unità di una proteina che agisce come un messaggero tra le cellule e modula le risposte immunitarie;
- BLK è un gene a cellule B, che potrebbe spiegare l’aumento del numero di anticorpi.
La netta prevalenza del sesso femminile, (9:1), può essere verosimilmente attribuita all’influenza degli estrogeni (4), che aumentano l’attivazione policlonale dei linfociti
B e la formazione di autoanticorpi, attivando il sistema immunitario. Vi sono molti studi in merito alla correlazione fra SS e infezioni; in particolare il Citomegalovirus (CMV) e il virus di Epstein Barr (EBV) (5), sono considerati possibili induttori della malattia. Questi virus hanno, infatti, un facile accesso (tropismo) alle ghiandole salivari e potrebbero innescare le reazioni autoimmuni verso le stesse, sia con un meccanismo di attivazione aspecifica policlonale B linfocitaria sia con un meccanismo di mimetismo molecolare, cioè inducendo una risposta autoimmunitaria verso antigeni virali capace però di coinvolgere anche strutture self, appartenenti cioè all’organismo (5). Per quanto riguarda la patogenesi, la SS è caratterizzata da un’espansione policlonale dei linfociti B (un’attivazione dei linfociti di tipo B) e da un’ipergammaglobulinemia con presenza di autoanticorpi. Gli autoanticorpi mediano il danno alle ghiandole lacrimali provocando la distruzione del dotto secretorio mentre a livello delle salivari provocano un ingrossamento dei dotti escretori con successiva atrofia e distruzione della ghiandola stessa. Alterazioni analoghe possono verificarsi a livello di tutte le ghiandole dell’organismo con conseguente secchezza della cute, della vulva, dell’albero bronchiale, della gola e della mucosa nasale. La sensazione di secchezza oculare e salivare è comunque comune tra la popolazione e può avere cause diverse dalla pSS come l’infezione da virus dell’epatite, quella da HIV, l’amiloidosi, la sarcoidosi, la sclerosi multipla. Inoltre interferenze metaboliche causate da alcuni farmaci, diuretici, antiipertensivi, antidepressivi, abuso di alcool, droghe e stress, possono provocare quadri sintomatologici sovrapponibili a quelli della SS, rendendo difficile una diagnosi differenziale la quale oltre ad un’accurata anamnesi, deve essere supportata dalle prove di produzione delle lacrime e della saliva, e dagli esami immunologici. Questo iter diagnostico in realtà è generalmente effettuato in modo non conforme al protocollo AECG e spesso non completo, con il risultato di sottostimare l’incidenza della SS e questo può giustificare il fatto che,allo stato attuale la sindrome di Sjogren è considerata una malattia “RARA”.
La Sindrome di Sjögren non è inserita nei LEA e nel Registro Nazionale delle malattie rare, sebbene più grave di tante altre malattie rare ivi classificate. Alle problematiche della malattia va aggiunto il disagio e la sofferenza dei malati per i quali non ci sono farmaci curativi e, l’uso di parafarmaci, farmaci di fascia C, terapie riabilitative fisiche e cure odontoiatriche sono a carico del paziente. La possibilità di una diagnosi certa, si basa dunque nel rispetto di protocolli ampiamente accettati come quello dell’American, (AEGC), (6), riportato in tabella 1, che prevede il riconoscimento di sintomi e segni oculari ed orali , nonché positività ad un eventuale esame istopatologico (biopsia delle salivari minori), e/o al test di interessamento ghiandolare, con ricerca di anticorpi anti-Ro(SSA), o anti-La(SSB), nel siero. Lo scopo di questo studio è di dimostrare che questo iter diagnostico, che in
Italia spesso non è seguito, può essere di fatto reso praticabile in ambito territoriale, instaurando una procedura d’interazione tra lo specialista oculista, e quello otorinolaringoiatra, che generalmente sono presenti nello stesso giorno nella medesima struttura. Ambulatoriale. Il problema della mancanza del laboratorio di Analisi Cliniche che deve effettuare gli esami sierologici,può essere superato affidando la ricerca degli autoanticorpi allo stesso specialista ORL, con l’impiego di un test rapido come quello dell’Immuno –Blot, eseguito, non sul siero ma sulla saliva subito dopo l’esame del flusso salivare. Con questo studio intendiamo quindi verificare, come del resto espresso chiaramente dal (AEGC), la possibilità di diagnosticare la Sindrome di Sjögren ambulatorialmente in tutti i pazienti che all’anamnesi presentino sintomatologia sospetta almeno per la presenza di un sintomo “secco” e nel contempo ricavare i dati della prevalenza per il campione sotto esame.
MATERIALI E METODI
È stata effettuata uno studio con raccolta dei dati anamnestici su circa settemila pazienti, riguardante la presenza di sintomatologie e di segni, relativi ad una possibile insorgenza della sindrome di Sjogren primaria e più precisamente:
- visita oculistica, raccolta dati anamnestici relativi a sintomi oculari ed esecuzione del test di Schirmer;
- esecuzione del test di Schirmer; valore di riferimento per positività 😕 5mm in 5 minuti;
- esame e ricerca degli anti –Ro(SSA),e/o anti –La (SSB), nel campione di saliva derivante dalla misura del flusso salivare, mediante tecnica Immuno-Blot eseguita con il Kit della AESKU DIAGNOSTIC, distribuito dalla GRIFOLS ITALIA* ;
- immuno-Blot Assay. Principio del test e metodo modificato per l’uso su saliva umana.
Gli antigeni sono fissati in linee parallele su una membrana di nitrocellulosa. La membrana è stabilizzata per evitare reazioni aspecifiche, e le strisce con gli specifici antigeni fissati in posizioni ben definite, vengono incubate, con agitazione per 20 minuti, nel campione di saliva tal quale nella quantità di1 ml. Gli anticorpi del soggetto se presenti nel campione si legano con l’antigene e la frazione non legata viene eliminata successivamente, tramite lavaggio mediante una siringa con 3 cc (x 3) di soluzione tampone. Le immunoglobuline anti-umane sono poi coniugate con 0.8 cc di perossidasi di rafano (Coniugato),vengono incubate ed agitate per 20 min e reagiscono con il complesso anticorpo antigene del campione. Il coniugato non legato viene eliminato successivamente con un solo lavaggio di cinque cc di soluzione tampone, a cui segue l’aggiunta di 0.5 cc di substrato TMB, incubato per 20 minuti,che provoca una reazione enzimatica che lo converte in un precipitato colore blu.
RISULTATI
Nel corso di un periodo di circa sei mesi è stata fatto uno screening di tipo anamnestico su circa 4000 pazienti in visita oculistica e/o otorinolaringoiatra negli ambulatori delle strutture ICP territoriali. Con la formulazione delle domande anamnestiche volte al riconoscimento di eventuale presenza dei principali sintomi oculari e orali come espressi dal protocollo stabilito dall’American European Consensus Group, sono stati individuati venti pazienti sui su quali effettuare il test di Schirmer, la prova del flusso salivare e per ultimo la ricerca degli autoanticorpi nella saliva mediante l’utilizzo del metodo Immuno –Blot.
Questa procedura di screening permette di ottenere alla fine dei test la conferma della presenza o meno della sindrome di Sjogren in ottemperanza al protocollo, che vedi tabella 1, impone che siano soddisfatte per una positività certa della pSS le seguenti condizioni:
a) la presenza di almeno quattro dei sei criteri, sempre che in essi sia positivo o il criterio istopatologico o quello sierologico; nel nostro caso quello salivare
b) la presenza di almeno tre dei quattro criteri obiettivi e cioè fra III, IV, V, VI
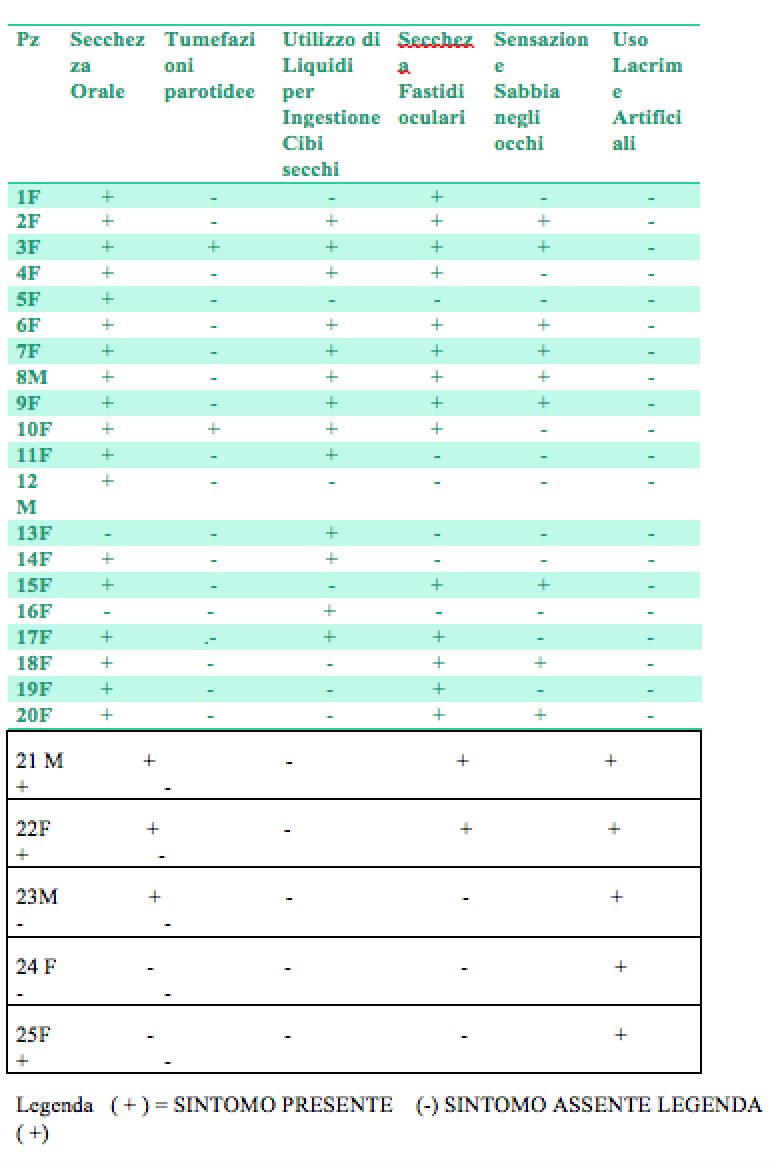
Da una prima lettura dei dati anamnestici di ammissione dei pazienti vedi tabella 2, si posso notare per essi le seguenti indicazioni
a) prevalenza del sesso femminile = 90%
b) sintomo orale prevalente, secchezza delle fauci = 90%
c) sintomo orale prevalente: secchezza e/o fastidi oculari 70%
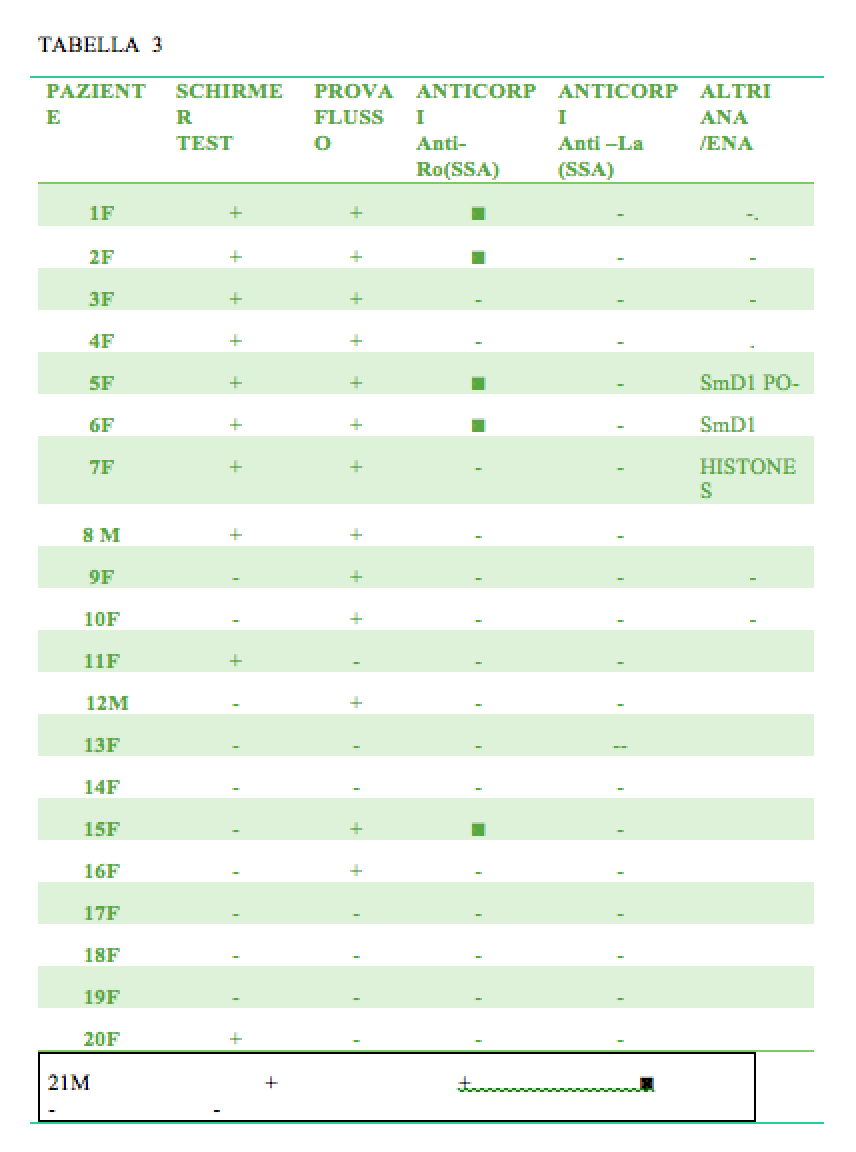
Dalla tabella 3 si evincono anche le prevalenze dei segni obiettivi
a) segno orale, prova di flusso positivo nel 60% dei casi
b) segno oculare test di Schirmer positivo nel 50% dei casi
I risultati espressi in tabella 3 indicano che in sette pazienti è positiva la ricerca degli autoanticorpi SSA. Per quattro di loro nei quali sono presenti solo gli anti-RoSSA,vedi immagine 1, è possibile stabilire una diagnosi certa di SS primaria secondo i criteri AECG; mentre due pazienti hanno una SS secondaria, (vedi immagini 2 e 4). In tabella 3 si nota che un caso presenta nella saliva, positività per Istoni, (immagine 3), per causa di altre patologie di tipo autoimmune, probabilmente LES. Un ottavo paziente (numero.15) è positivo al test di flusso salivare e per anti –Ro (SSA), ma nel rispetto del protocollo stabilito AECG non è stato possibile stabilire in via definitiva nell’ambito territoriale la diagnosi di pSS, per cui è stato inviato all’analisi istopatologia che ha confermato la presenza di SS primaria. La diagnosi di pSS nei pazienti positivi al test è stata confermata successivamente anche con l’esecuzione degli esami sierologici che hanno confermato ,la presenza degli autoanticorpi,oltre al loro titolo Il risultato finale indica una sensibilità del protocollo uguale al 80%. I dati ottenuti indicano inoltre che nel campione esaminato in questo studio la sindrome (pSS) ha un valore di prevalenza 7.2, come persone affette ogni 10000 abitanti .Questo valore è circa una volta e mezzo superiore a quello indicato come riferimento,a livello europeo,e ricavato dall’elaborazione delle indagini epidemiologiche che utilizzano i criteri di classificazione nati dallo stesso documento utilizzato in questa ricerca, ovvero quello relativo al consenso Americano-Europeo. I dati di molti studi concordano nello stimare la prevalenza della Sindrome di Sjögren primaria in Europa pari ad un valore di 1 ogni 2567 persone. Secondo la legislazione italiana per non essere considerata rara la prevalenza deve essere superiore allo 0.05%,ovvero un caso ogni 2500 persone.
DISCUSSIONE
La diagnosi della SS è in genere ottenuta dopo un iter diagnostico abbastanza complesso, il paziente denuncia alcuni disturbi, a volte definiti solo come sensazioni non ben specificate specialmente nell’arco temporale e quindi non correttamente classificabili come richiesto dal protocollo AECG. Inoltre il medico spesso tende a trascurare alcuni di questi disturbi fuorviato nel corso dell’anamnesi da altri fattori di confusione come l’assunzione di farmaci, lo stress, il consumo e/o abuso di sigarette e alcool. La proposta, che è alla base del seguente studio, prevede invece un preciso e rigido protocollo per le seguenti tappe diagnostiche da eseguirsi in ambito ambulatoriale:
a) anamnesi in accettazione otorinolaringoiatra e/o oculistica, indipendentemente dal suo scopo, per la ricerca di eventuali sintomi orali e oculari, secondo il protocollo AECG;
b) in risposta positiva ad almeno due dei parametri identificati nel protocollo, come ad esempio secchezza delle fauci e/o oculare, vengono di routine effettuati lo Schirmer test e la prova di flusso;
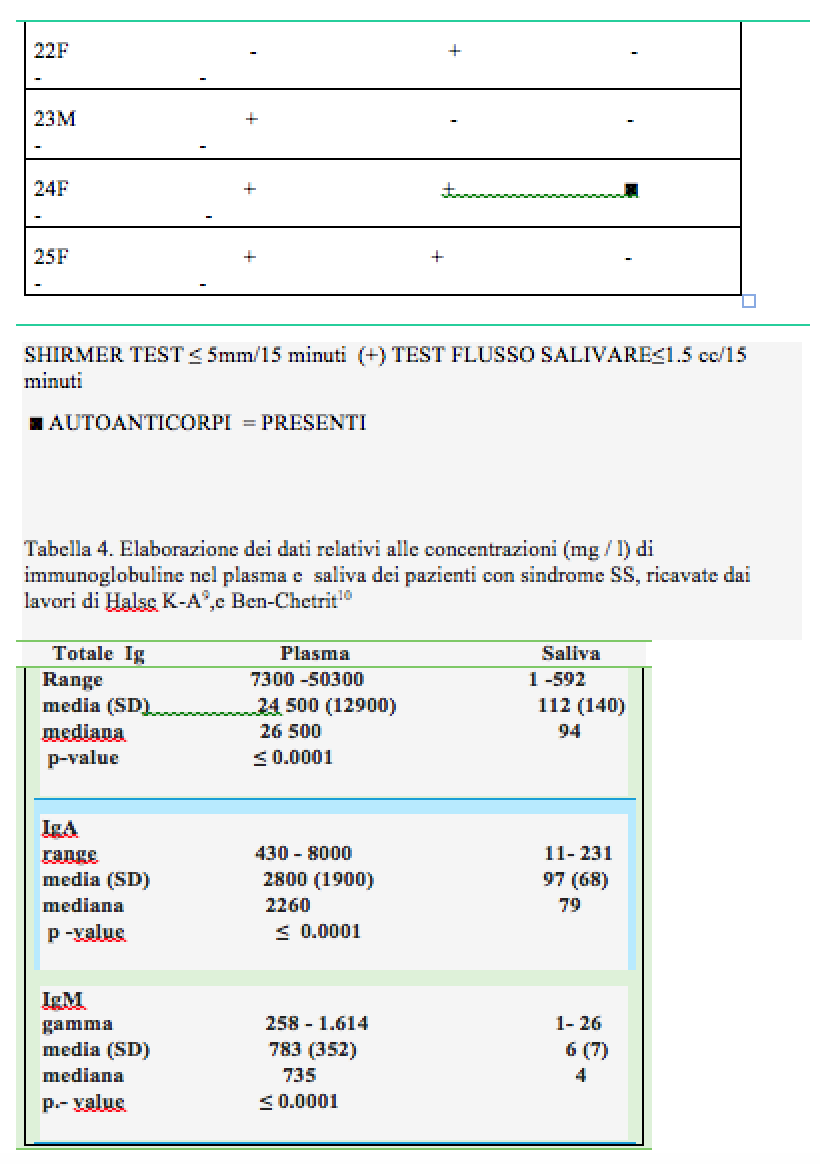
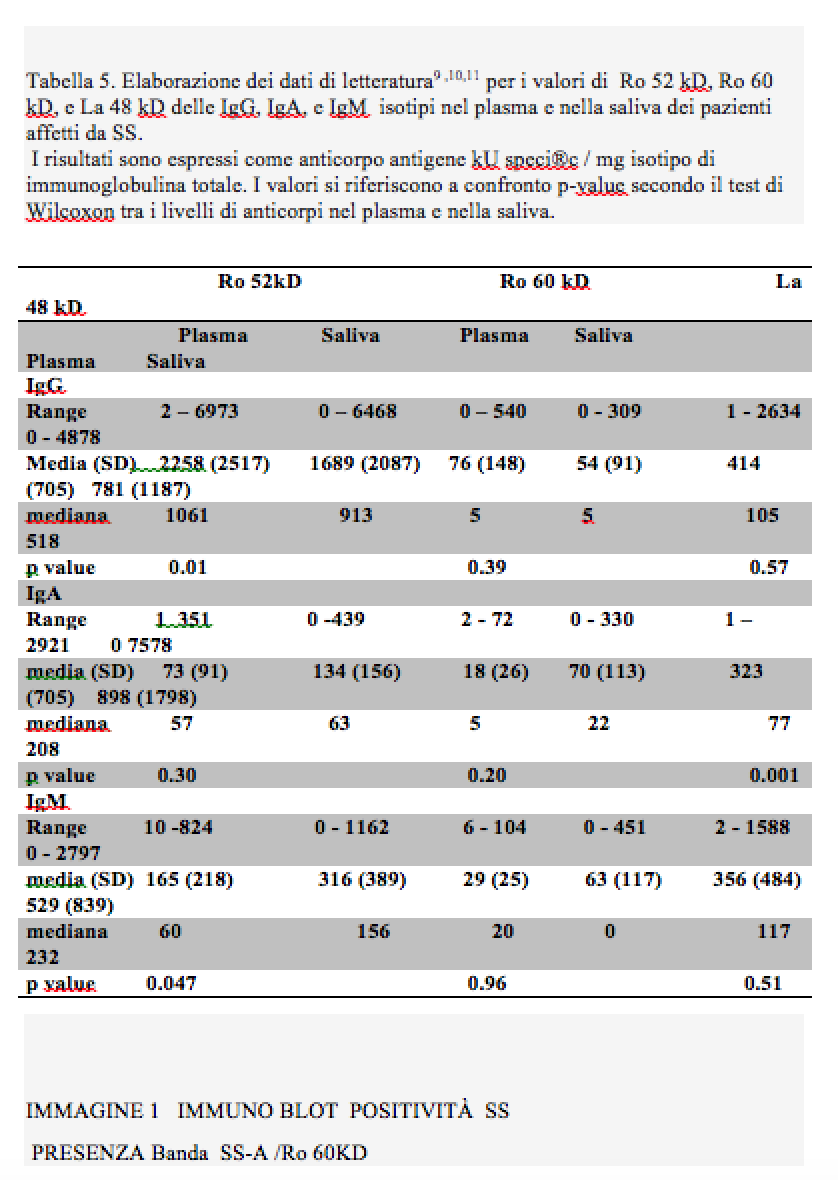
c) in base a questi risultati, ed essendo in ambito ambulatoriale e quindi non potendo effettuare test istologici, per avere una conferma della presenza di una pSS,deve essere effettuata la ricerca degli anticorpi anti-Ro(SSA), anti-La(SSA), nella saliva del paziente con il metodo Immuno Blot. Questo test è venduto dalle case produttrici per essere impiegato su campioni di siero e non è previsto il suo utilizzo per indagini sulla saliva umana. Questo limite è giustamente posto, perché la saliva per sua natura presenta molti vantaggi diagnostici, come la non invasività, la facile raccolta, e la relativa stabilità del campione differentemente da siero che, ottenuto mediante puntura venosa, e plasma, necessita dopo centrifugazione una conservazione a ± 20³Cfino al momento dell’analisi. Il limite della saliva è generalmente dovuto alla concentrazione degli anaboliti da ricercare che è molto più bassa che nel siero (7). In particolare questo saggio Immuno Blot ricerca nel siero ANA ed ENA la concentrazione della quale sono nella saliva anche mille volte inferiori, (8), vedi tabella. 4) In questo studio è stato ipotizzato di poter utilizzare questa metodica, secondo i recenti studi sulla composizione salivare delle immunoglobuline e in particolare quella riguardante la concentrazione delle anti-Ro (SSA), e anti-La (SSA), (9.).
Come si può vedere dalla tabella (5) , le concentrazioni nella saliva e nel siero delle Ig sono molto simili ed i risultati dello studio rilevano anche una significativa correlazione statistica.
Questo lavoro dimostra anche che la pSS aumenta i livelli di immunoglobuline nel plasma ma, proporzionalmente molto di più nella saliva. Le ipotesi che possono giustificare tali concentrazioni sono essenzialmente due e cioè che vi sia un travaso di proteine dai vasi sanguigni irroranti i tessuti delle ghiandole salivari, ma molto più probabilmente come recenti studi hanno dimostrato, (10), (11), per un’iperproduzione di Iga risposta del processo infiammatorio. Questa ricerca ha evidenziato risultati correlabili ai dati di letteratura citati: sono infatti stati rilevati in sette campioni bande di complesso/coniugato-autoanticorpo Ro (SSA), molto ben evidenti e della stessa intensità della banda di controllo, (vedi immagini 1 e 2). Inoltre a conferma dell’ipotesi di aumentata produzione nella SS primaria, ma anche in quella secondaria, delle varie componenti di Ig, si rilevano altre bande, come si può osservare dalla immagine 2,(SmD1 +anti-RoSSA), nella 3 (Istoni), ed infine nella 4 (SmD1 + PO+ anti-RoSSA). Questo tipo di analisi ha permesso di eseguire così anche una diagnosi di SS secondaria confermata dall’esame sierologico, in un controllo successivo. In questo studio è stata valutata, l’intensità delle bande se non visivamente, ma è possibile quantificare la concentrazione degli autoanticorpi con l’impiego di uno scanner e dosare il titolo esatto nei range stabiliti. Al di fuori delle strutture territoriali sono state effettuate le analisi sierologiche per la conferma dei risultati ottenuti con i test sulla saliva. Con i parametri di riferimento dei valori standard di laboratorio accettati per i titoli ANA e ENA, i risultati delle analisi hanno confermato le diagnosi accertate in questo studio. In questo contesto si può affermare che la determinazione dei titoli è superflua ai fini della ricerca e della proposta di questo lavoro essendo lo scopo della proposta quello di fare una diagnosi di pSS,indipendentemente dalla fase di attività della malattia che in nessun caso , è correlabile con il titolo dei vari autoanticorpi. Infatti il valore che viene dato al risultato degli ENA è per convenzione puramente indicativo di una positività più o meno marcata. Fanno eccezione, ma questo caso non rientra lo scopo di questo studio, i valori di anti1-RNP, che se riscontrati ad alto titolo, sono marcatori specifici per la connettivite mista. Nel caso di un riscontro di autoanticorpi SSA, questi fluttuano nel tempo, non scomparendo nelle fasi di remissione della malattia. In ogni caso tenendo conto che in conformità a questo studio, che ha come fine ultimo solo una corretta diagnosi della pSS,e non del suo stato di attività, bisogna ricordare che la ripetizione del test di ricerca nella saliva degli ENA,può essere ragionevolmente essere presa in considerazione solo nel caso di una sindrome di Sjogren secondaria per verificare una modificazione del quadro clinico,poiché ad anticorpi presenti,si possono aggiungere altre positività di ENA. In ultimo riguardo alle persone sicuramente trovate positive alla pSS, secondo i criteri AECG,ed in numero di quattro su 5000 persone visitate , ovvero otto su 10000, secondo i criteri stabiliti dall’Unione Europea la SS non potrebbe essere considerata una malattia rara almeno secondo i dati di questo studio L’Unione Europea infatti,definisce una malattia come rara quando il numero dei casi presenti in una data popolazione non superi lo 0.05%, in altre parole una persona ogni 2000. Considerato che in Italia ci sono poco più di 16 mila persone accertate che soffrono della pSS, dal punto di vista meramente numerico, questa malattia dovrebbe rientrare nella definizione di rara. In effetti i dati di questo studio sono relativi ad una fascia di popolazione visitata nella quale non sono stati praticamente visitati i giovani al di sotto dei venti anni,anche se la incidenza fra essi è molto bassa (? 5%). In ogni caso il dato ricavato deve essere comunque preso in forte considerazione.
CONCLUSIONI
Il problema della diagnosi della pSS è stato affrontato in questa ricerca preliminare non solo per l’aspetto puramente biomedico, in accordo con il protocollo AECG,ma anche per quello logistico e temporale. Il paziente nell’ambito della stessa struttura, appartenente agli “Ambulatori Territoriali ICP” di Milano, ha avuto in un solo giorno la risposta ad un quesito diagnostico molto importante su una patologia che in alcuni casi poteva essere solo latente. Certamente con questo tipo di approccio integrato, devono essere rivalutate e esaltate le competenze interne alla stessa struttura, comprese quelle infermieristiche che sono essenziali specialmente nella fase di ricerca degli autoanticorpi con il metodo dell’Immuno Blot. L’ultima e non meno importante osservazione riguarda, il valore di prevalenza accertato in questo studio, circa una volta e mezzo superiore di quello prospettato in altri lavori, e che pone il quesito, ove trovi conferma in altre esperienze, se ancora oggi la sindrome di pSS possa considerarsi una patologia rara, cioè non superi la percentuale dello 0.05%, ovvero una persona ogni 2000 abitanti.
BIBLIOGRAFIA
1) Organizzazione Italiana di Reumatologia; www.Reumatologia.Org.Patologia/05.it
2) Bolstad I A,Jonsson R.Genetic Aspects Of Sjögren’s Syndrome .Arthritis Res 2002, 4:353-359
3)Jessard L C,He Li,Adrianto I,John A Ice,Rasmussen A,et al.Variants at multiple loci implicated in both innate and adaptive immune responses are associated with Sjogren syndrome ,Nature Genetics 2014;Nov,45(11):1284-92
4) Hayashi Y,Arakaki R Ishima.Apoptosis and estrogen deficiency in primary Sjogren Syndrome Curr Opin Rheumatol. 2004 Sep;16(5):522-6
5)Sjogren Syndrome .Anne V Miller 2010, Chief Editor: Herbert S Diamond, MD.Diamond MD
6) Vitali C1, Bombardieri S, Jonsson R, Moutsopoulos HM, Alexander EL, Carsons SE, Daniels TE, Fox PC, Fox RI, Kassan SS, Pillemer SR, Talal N, Weisman MH; European Study Group On Classification Criteria For Sjögren’s Syndrome.Classification Criteria For Sjögren’s Syndrome: A Revised Version Of The European Criteria Proposed By The American-European Consensus Group. Ann Rheum Dis. 2002 Jun;61(6):554-
7) Pink R1, Simek J, Vondrakova J, Faber E, Michl P, Pazdera J, Indrak K Saliva As A Diagnostic Medium Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub. 2009 Jun;153(2):103-10.
8) Haga HJ1, Hulten B, Bolstad AI, Ulvestad E, Jonsson Reliability And Sensitivity Of Diagnostic Tests For Primary Sjögren’s Syndrome.See comment in PubMed Commons belowJ Rheumatol. 1999 Mar;26(3):604-8.
9)A.-K. Halse, M.C. Marthinussen, M. Wahren-Herlenius, And R. Jonssonscand Isotype Distribution Of Anti-Ro/SS-A And Anti-La/SS-B Antibodies In Plasma And Saliva Of Patients With Sjoè Gren’s Syndromej Rheumatol 2000;29:13
10). Ben-Chetrit E, Fischel R, Rubinow A. Anti-SSA/Ro And Anti-SSB/La Antibodies In Serum And Saliva Of Patients Withsjogren’s Syndrome. Clin Rheumatol 1993;12:471 ± 4.
11) Busamia B1, Gonzales-Moles MA, Mazzeo M, Linares J, Demarchi M, Gobbi C, Albiero E, Finkelberg A. Assessing The Determination Of Salivary Electrolytes And Anti-Ro And Anti-La Antibodies For The Diagnosis Of Sjögren’s Syndrome (SS).See comment in PubMed Commons belowMed Oral Patol Oral Cir Bucal. 2010 May 1;15(3): E437-40.
Tabella 1. Criteri diagnostici dell’American-European Consensus Group
I. Sintomi oculari: risposta positiva ad almeno uno dei seguenti quesiti:
1. Secchezza e fastidio oculare quotidiano e persistente per un periodo superiore a tre mesi
2. Sensazione ricorrente di sabbia negli occhi e di corpo estraneo
3. Utilizzo di lacrime artificiali più di tre volte al giorno
II. Sintomi orali: risposta positiva ad almeno uno dei seguenti quesiti:
1. Sensazione di secchezza orale quotidiana per un periodo superiore a tre mesi
2. Tumefazioni parotidee ricorrenti o persistenti
3. Utilizzo di liquidi per l’ingestione di cibi secchi
III. Segni oculari: positività ad almeno uno dei seguenti test:
1. Test di Schirmer (4 secondo Von Bijservedl)
IV. Esame istopatologico: Reperto di sialoadenite linfocitica focale nella biopsia delle ghiandole salivari minori ottenuta da una mucosa apparentemente normale e, con un focus score ? 1, definito come il numero di foci linfocitari adiacenti ad acini di mucosa apparentemente normale e contenenti più di 50 linfociti per 4mm2 di tessuto ghiandolare.
V. Ghiandole salivari: interessamento delle ghiandole salivare documentato dalla positività di almeno uno dei seguenti test:
1. Scintigrafia delle ghiandole salivari
2. Scialografia delle parotidi
3. Misura del flusso salivare non stimolato (?1,5 ml in 15 minuti)
VI. Autoanticorpi: presenza nel siero dei seguenti anticorpi: anti-Ro(SSA) e/o anti-La(SSB)
Per la Sindrome di Sjögren primaria
In pazienti privi di altra patologia potenzialmente associata, la SS primaria può essere definita come:
a) La presenza di almeno 4 dei 6 criteri è indicativa di SS primaria, purchè siano soddisfati i criteri V (istopatologia) o VI (sierologia).
b) La presenza di almeno tre dei quattro criteri obiettivi (cioè III, IV, V, VI).
Per la Sindrome di Sjögren secondaria
In pazienti con una patologia potenzialmente associata (per esempio un’altra patologia del tessuto connettivo), la presenza del I o del II criterio, più almeno due tra i criteri III, IV e V, può essere indicativa di Sindrome di Sjögren secondaria.
TABELLA 2. VALUTAZIONE SCRENING SINTOMI ORALI E OCULARI
In assenza di anamnesi positiva per fattori esterni farmaci et altro