A. Caranti¹, A. Cimatti²
1 Medicine student at Otorhinolaringoiatric department at San Pier Damiano Hospital, Faenza (Ravenna), Italy
2 Head of Otorhinolaringoiatric dept. at San Pier Damiano Hospital, via Portisano 1, 48018 Faenza (Ravenna), Italy
ABSTRACT
Lo Pseudotumor Infiammatorio della ghiandola parotide è un reperto clinico benigno di origine sconosciuta, raramente riportato in letteratura con appena 12 casi riportati. Il profilo clinico e radiografico è simile, e spesso confuso, con quello di altri tumori maligni, e solo una indagine istologica può permettere di discriminarlo. Nel nostro report descriviamo un caso di Pseudotumor Infiammatorio della ghiandola parotide in un uomo di 53 anni, HIV e HCV positivo, che si rivolse alla nostra clinica per l’esecuzione di una rimozione chirurgia di una massa in parotide destra. L’ecografia, la TC e l’esame clinico pre-operatorio mostrarono una nodularità con margini regolari che lasciava propendere per un tumore di Warthin. L’esame istologico eseguito sul pezzo chirurgico ha concluso invece per una lesione fibrosa proliferativa con un infiltrato infiammatorio e positiva per la colorazione all’Actina, quadro compatibile con diagnosi di Pseudotumor Infiammatorio.
CASO CLINICO
Un paziente maschio di 53 anni viene ammesso presso la nostra struttura nel novembre 2015 per una tumefazione della ghiandola parotide destra. La lesione non si associava ad alcun sintomo sistemico rivelante come febbre, astenia o perdita di peso. L’esame clinico rilevò la presenza di un nodulo duro con bordi regolari e non dolorante né dolorabile alla palpazione. In anamnesi, il paziente risultava positivo per HIV e portatore cronico di HCV. Egli aveva anche una storia di positività per HBV e HAV. Egli era anche un forte fumatore (20 sigarette al dì), fu esposto ad asbesto sul luogo di lavoro, ed aveva una storia di BPCO con sporadici focolai acuti a livello del polmone destro. Era inoltre ipercolesterolemico e con un BMI di 27,3Kg/m2. In passato, la presenza di ricorrenti tumefazioni della tiroide portò alla scoperta di una ciste tiroidea non associata a modificazioni del TSH. In passato, il paziente fu operato di tonsillectomia, appendicectomia, riparazione del tendine di Achille e turbinoplastica. Gli esami ematochimici non mostravano nulla di rilevante (GR e GB nella norma, PCR < 0,1 mg/dl, Fibrinogeno 441, Creatinina 0,70 mg/dl e non disionemie). L’esame ecografico mostrava un moderato aumento di volume della ghiandola parotidea destra e, nello spessore del parenchima, una massa nodulare ipo-anaecogena di 20×32 mm, caratterizzata da un margine regolare e da un moderato aumento del flusso ematico. Alla TC, eseguita senza e con mdc, mostra una neoformazione di 30x20x25 mm, con un margine regolare compatibile con una diagnosi di tumore di Warthin. Non vi erano invece evidenze di tumefazioni laterocervicali. In accordo con il paziente, si programmò l’escissione chirurgica del lobo laterale della tiroide che includeva la massa. Dopo due giorni di convalescenza, il paziente è stato dimesso senza complicazioni. L’esame istologico della massa rivelò la presenza di una lesione sclerosante proliferativa del parenchima e di un linfonodo intraparotideo. Inoltre, si ritrovarono anche macrofagi schiumosi. L’esame di immunoistochimica ulteriormente svolto mostrò una positività per l’Actina ed una negatività per Keratina, S-100, Caldesmone, P-63, Desmina e CD-34. Un test di alcol acido resistenza per la ricerca di micobatteri risultò negativo. La diagnosi conclusiva fu di Pseudotumor Infiammatorio, probabilmente dovuto ad un evento reattivo. Dopo due mesi di followup, il paziente non riportò complicanze connesse all’intervento chirurgico.
DISCUSSIONE
Lo Pseudotumor Infiammatorio (PSI) può essere definito come una massa localizzata costituita da uno stroma fibroso ed un infiltrato infiammatorio cronico con una predominanza di plasmacellule e istiociti, oltre che essere caratterizzato per l’assenza di displasia e di figure mitotiche (1). Venne descritto per la prima volta nel 1939 da Brunn. È una patologia che interessa più spesso bambini e giovani adulti, con una preferenza per le donne e per le popolazioni non-europee. Il PSI può apparire in diversi organi del corpo umano, con una frequenza maggiore per polmone, fegato, milza e orbita (2,3). È altresì noto come tumore infiammatorio miofibroblastico, granuloma a plasmacellule, pseudotumor xantomatoso o fibrosarcoma infiammatorio (4). Someren, nel 1978, ha classificato il PSI in 3 categorie basate sui rilevamenti istologici:
1. Tipo Xantogranuloma (o tipo istiocitario)
2. Tipo granuloma a plasmacellule
3. Tipo sclerotico (o granuloma sclerosante) (3,4)
Microscopicamente, le lesioni sono caratterizzate in base a quattro componenti tipiche: istiociti, miofibroblasti, plasmacellule e linfociti. Queste cellule risultano positive per colorazioni all’Actina, Vimentina e CD3. Lo stroma è spesso edematoso e con un aumento della vascolarizzazione. Macroscopicamente, lo Pseudotumor può emulare una neoformazione maligna, manifestandosi come una lesione isolata o multifocale, con dimensioni che possono andare da 1 a 25 cm (4). All’ecografia si manifesta come una lesione rotondeggiante dai margini regolari e priva di calcificazioni (2). L’eziopatogenesi è attualmente sconosciuta e le teorie principali includono una reazione infiammatoria dovuta ad un agente infettivo, un traumatismo, una ischemia o un disturbo autoimmune (2,4). In particolare, Arber et al propongono una ipotesi basata su di un’infezione da Epstein-Barr virus del parenchima (5). D’altra parte, Kamisawa et al sostengono che un disturbo autoimmune come la colangite sclerosante IgG4 può altrettanto portare a Pseudotumor (6). A livello del testa collo sono stati descritti PSI a livello di orbite, laringi, rinofaringe, seni mascellari, ghiandola tiroide e ghiandole salivari (in particolare la parotide), con un solo caso riportato in letteratura associato a ghiandola sottomandibolare (3,7). Nella ghiandola parotide, lo pseudotumor si manifesta con una tumefazione della ghiandola. Alla palpazione, la massa è un nodulo duro che può essere associato ad una tumefazione laterocervicale, dolore e sintomi sistemici come febbre, astenia e perdita di peso. D’altra parte, un coinvolgimento del nervo faciale è stato documentato (2,3). In letteratura, non ci sono report che riportino la positività per marker tumorale (come ? fetoproteina, antigene carcinoembrionali, ecc.), sia a livello ematico che a livello istologico. Altre indagini di laboratorio possono risultare negativi o possono presentare aumento della VES, della PCR e, a volte, un aumento della conta leucocitaria. L’ispezione clinica e la TC non sono conclusivi, ma aprono a diagnosi differenziali fatte con altre patologie infiammatorie o neoplasie maligne. Un FCNA non è sempre conclusivo quindi si rende necessaria una biopsia per confermare la diagnosi (1). Una terapia con corticosteroidi ha una efficacia non riconosciuta, ad eccezione del PSI retro-orbitario. L’escissione chirurgica è l’unica terapia curativa riconosciuta, con casi di recidiva molto rari (2).
BIBLIOGRAFIA
1) Thirumaran N.S. et al. – “Inflammatory pseudotumor of Parotid Gland – a case report” – Journal of Evolution of Medical and Dental Sciences/ Volume 2/ Issue 42/ October 21, 2013;
2) Oudidi A. et al. – “Inflammatory pseudotumors of parotid gland. One case study” – La Lettre d’Oto-rhino-laryngologie et de chirurgie cervico-faciale – no 302 – janvier-février – 2006;
3) Barrios Sánchez G.M. et al. – “Inflammatory pseudotumor of the parotid gland” – Med Oral Patol Oral Cir Bucal 2005;10:371-5;
4) Zhang Y. et al. – “Inflammatory pseudotumor of the liver: A case report and literature review” – Intractable Rare Dis Res. 2015 Aug; 4(3): 155–158;
5) Arber D. et al. – “Frequent presence of the EpsteinBarr virus in inflammatory pseudotumor” – Hum Pathol 1995;26:1093-8;
6) Kamisawa T. et al. – “IgG4-related sclerosing disease” – World J Gastroenterol. 2008 Jul 7; 14(25):3948-55.;
7) Williams S.B. et al. – “Inflammatory Pseudotumors of the Major Salivary Glands. Clinicopathologic and immunohistochemical analysis of six cases.” – Am J Surg Pathol 1992;16:896902.
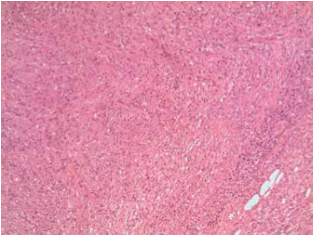 Fig. 1
Fig. 1
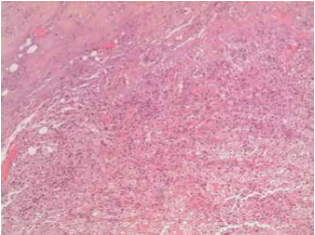 Fig. 2
Fig. 2
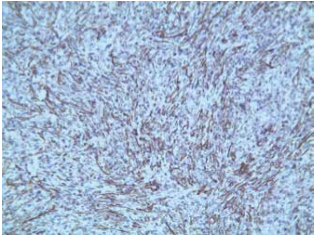 Fig. 3
Fig. 3