M. Duca*,Roberto Menicagli^
*Ospedale Bassini, Milano
^Romabiomedresearch Mediglia, Milano
ABSTRACT
According to the American-European Consensus Group (AECG) is carried out diagnosis of primary Sjögren’s syndrome (pSS), detecting, the presence of a sign eyepiece, a salivary, the appearance in the serum of specific autoantibodies and / or positive histopathology salivary glands In fact, the lack in public clinics, the structures of serological tests and / or histologically, is impossible to make the diagnosis in a single day. The aim of the study is to diagnose (pSS), in these structures, using a diagnostic integral eye exam and ENT, simultaneously looking for anti-Ro (SSA), anti-La (SSA) in the saliva of patients by the, ENT specialist.
MATERIALS AND METHODS: Twenty-five of about seven thousand patients, visiting ENT and / or suspected history of ophthalmology presented (pSS) .On these, was carried out the test of salivary flow, the detection of autoantibodies ANA / ENA in saliva with Immuno Blot, the eye examination with performing the Schirmer test. The criteria for the diagnosis is indicated by (AECG).
RESULT The four patients tested positive to the Schirmer test and salivary flow and saliva were present anti-Ro (SSA), and according to the protocol (AECG), suffering (pSS). Two patients positive for anti-Ro (SSA), SMD1 and PO, are a likely secondary Sjogren, while another positive Histones are suspected SLE. For a another patient has recourse histopathological examination to confirm the diagnosis of pSS, because it was not possible with this diagnostic procedure having found anti-red, but positivity only salivary flow. The sensitivity of the diagnostic is equal to 80% The data obtained indicate a prevalence of SS of 7.2 / 10,000 patients
CONCLUSIONS: This study, using the skills clinic offers a new integrated diagnostic for the diagnosis of pSS according to the criteria (AECG)., and raises a new the question of the SS “rare disease”.
INTRODUCTION
Primary Sjogren’s syndrome (pSS), or Sicca syndrome (1), is a chronic inflammatory disease characterized by dry eyes (xerophthalmia) and mouth (xerostomia), an autoimmune pathogenesis, due to a reduction in the secretion of the lacrimal gland and salivary. The SS can also be secondary, in association with other autoimmune diseases such as rheumatoid arthritis, systemic lupus erythematosus and systemic sclerosis. The pSS may be accompanied by lymphocytic infiltration of different organs and tissues and can lead to nephritis and / or interstitial pneumonia and is associated with an increased risk of developing lymphoproliferative disorders. The etiology of pSS is yet to be clarified and that is probably multifactorial, genetic and environmental. The importance of genetic factors is confirmed by the association between pSS and some of the HLA phenotypes (2), in particular: in the sub-region D DR, encoding HLA class 2, namely:
• DRW52
• DR3: form associated with anti-SSA and -SSB
• DR4: form associated with rheumatoid arthritis
Recently more and more studies show the genetic aspects, primarily with the work done by the team that was able to identify six new genes probably associated with SS. Il international team of researchers is part of the project SGENE and identified these genes related to the disease ( 3.), which are:
• IRF5 and STAT4 that are “master regulators” that activate the cells during an immune response.
• CXCR5 controls the turnover of cells and may help explain why the immune cells target moisture-producing glands.
• TNIP1 is a binding partner with another gene encoding autoimmunity related to the diseas.
TNFAIP3, that “cut” the mechanisms of self-regulation on the immune system.
• IL12A is a sub-unit of a protein that acts as a messenger between cells and modulates immune responses.
• BLK is a gene in B cells, which could explain the increase in the number of antibodies.
The prevalence of the female sex, (9: 1), can probably be attributed to the influence of estrogen (4), which increase the polyclonal activation of B cells and the formation of autoantibodies, activating the immune system. There are many studies about the correlation between SS and infections; in particular the cytomegalovirus (CMV) and Epstein Barr virus (EBV) (5), are considered possible inducers of the disease. These viruses have, in fact, easy access (tropism) in the salivary glands and may trigger autoimmune reactions to the same, with both a trigger mechanism nonspecific polyclonal B lymphocyte is a mechanism of molecular mimicry, ie, inducing an autoimmune response to antigens viral but able to involve structures self, that is, belonging to the body (5) .As for the pathogenesis, the SS is characterized by polyclonal expansion of B lymphocytes (an activation of the lymphocytes of type B) and by hypergammaglobulinemia with the presence of autoantibodies. Autoantibodies median damage to the tear glands causing the destruction of the product while at the level of salivary secretory cause a swelling of the excretory ducts with subsequent atrophy and destruction of the gland itself. Similar alterations may occur at the level of all the glands of the body resulting in dry skin, vulva, of the bronchial, throat and nasal mucosa. The sensation of dry eyes and saliva is still common among the population and may have causes other than pSS such as infection with hepatitis, the HIV infection, amyloidosis, sarcoidosis, multiple sclerosis. Also metabolic interference caused by certain medications, diuretics, antihypertensives, antidepressants, alcohol abuse, drugs and stress can cause symptom patterns similar to those of the SS, making it difficult differential diagnosis which in addition to a thorough medical history, must be supported by test production of tears and saliva, and the immunological diagnostic This really is generally carried out in a manner inconsistent with the Protocol AECG and often incomplete, resulting in underestimation of the incidence of the SS, and this may account for the fact in this moment Sjogren’s syndrome is considered a “Rare” disease .The Sjögren’s syndrome, so not included in the LEA and the National Register of rare diseases, although more serious than many other rare diseases classified therein . At issues disease must be added the hardship and suffering of the sick for whom no curative medicines and the use of drug-end C, physical rehabilitation therapy and dental care are borne by the patient. The possibility of a certain diagnosis, is therefore based on the respect of protocols widely accepted as that of ‘American, (AEGC), (6), shown in Table 1, which provides for the recognition of symptoms and signs ocular and oral as well as positivity to any histopathological examination (biopsy of the minor salivary), and / or testing of glandular involvement, with antibodies anti-Ro (SSA), or anti-La (SSB), in serum. The purpose of this study is to show that this diagnostic process, which in Italy often is not followed, it may in fact be made practicable in territorial scope, establishing a procedure for interaction between the specialist ophthalmologist, and that otolaryngology, which generally are present the same day in the same structure. Outpatient. The problem of lack of laboratory of clinical analysis to be made by serological tests, can be overcome through outsourcing the detection of autoantibodies to the same ENT specialist, with the use of a rapid test such as immune-Blot, performed, not on the serum but the saliva immediately after the examination of the salivary flow. With this study we intend to then test, as is clearly expressed by (AEGC), the ability to diagnose Sjögren’s syndrome outpatients in all patients who present symptoms suspected to history for at least the presence of a symptom “dry” and in while deriving the data for the prevalence of the sample under examination.
Sinonimi di La sindrome di Sjogren primaria (pSS), o sindrome Sicca(1), è una malattia infiammatoria cronica, caratterizzata da secchezza degli occhi (xeroftalmia) e della bocca (xerostomia), a patogenesi autoimmune, dovuta a una riduzione della secrezione delle ghiandole lacrimali e salivari.. La SS può anche essere secondaria, in associazione ad altre patologie autoimmuni come l’artrite reumatoide, il lupus eritematoso sistemico e la sclerosi sistemica progressiva. La pSS può accompagnarsi a un’infiltrazione linfocitaria di differenti organi e tessuti e può portare a nefrite e/o polmonite interstiziale ed è associata ad un aumentato rischio di sviluppare patologie linfoproliferative. L’eziopatogenesi della pSS è ancora tutta da chiarire e probabilmente multifattoriale ovvero, genetica e ambientale. L’importanza dei fattori genetici è confermata dall’associazione tra pSS e alcuni fenotipi del HLA (2),in particolare :nella regione D sottoregione DR,codificanti antigeni HLA di classe 2,ovvero: • DRW52 • DR3: forma associata ad anticorpi anti-SSA e -SSB • DR4: forma associata ad artrite reumatoide Recentemente sempre più studi evidenziano gli aspetti genetici, principalmente con il lavoro svolto dal team che è stato in grado di identificare sei nuovi geni probabilmente associati alla SS.Il team internazionale di ricercatori fa parte del progetto SGENE ed ha identificato questi geni correlati alla malattia (3.) ,che sono: • IRF5 e STAT4 che sono “regolatori master” che attivano le cellule durante una risposta immunitaria • CXCR5 controlla il turn-over dei linfociti e può aiutare a spiegare il motivo per cui le cellule immunitarie bersaglio ghiandole produttrici di umidità. • TNIP1 è un partner di legame con un altro gene di codifica di autoimmunità correlato alla malattia, TNFAIP3, che “taglia” i meccanismi di autoregolazione sul sistema immunitario. • IL12A è una sub-unità di una proteina che agisce come un messaggero tra le cellule e modula le risposte immunitarie. • BLK è un gene a cellule B, che potrebbe spiegare l’aumento del numero di anticorpi La netta prevalenza del sesso femminile, (9:1),può essere verosimilmente attribuita all’influenza degli estrogeni (4), che aumentano l’attivazione policlonale dei linfociti B e la formazione di autoanticorpi,attivando il sistema immunitario. Vi sono molti studi in merito alla correlazione fra SS e infezioni; in particolare il Citomegalovirus (CMV) e il virus di Epstein Barr (EBV) (5), sono considerati possibili induttori della malattia. Questi virus hanno, infatti, un facile accesso (tropismo) alle ghiandole salivari e potrebbero innescare le reazioni autoimmuni verso le stesse, sia con un meccanismo di attivazione aspecifica policlonale B linfocitaria sia con un meccanismo di mimetismo molecolare, cioè inducendo una risposta autoimmunitaria verso antigeni virali capace però di coinvolgere anche strutture self ,appartenenti cioè all’organismo(5).Per quanto riguarda la Pagina 3 patogenesi, la SS è caratterizzata da un’espansione policlonale dei linfociti B (un’attivazione dei linfociti di tipo B) e da un’ipergammaglobulinemia con presenza di autoanticorpi. Gli autoanticorpi mediano il danno alle ghiandole lacrimali provocando la distruzione del dotto secretorio mentre a livello delle salivari provocano un ingrossamento dei dotti escretori con successiva atrofia e distruzione della ghiandola stessa. Alterazioni analoghe possono verificarsi a livello di tutte le ghiandole dell’organismo con conseguente secchezza della cute, della vulva, dell’albero bronchiale, della gola e della mucosa nasale. La sensazione di secchezza oculare e salivare è comunque comune tra la popolazione e può avere cause diverse dalla pSS come l’infezione da virus dell’epatite, quella da HIV, l’amiloidosi, la sarcoidosi, la sclerosi multipla. Inoltre interferenze metaboliche causate da alcuni farmaci, diuretici, antiipertensivi, antidepressivi, abuso di alcool, droghe e stress, possono provocare quadri sintomatologici sovrapponibili a quelli della SS, rendendo difficile una diagnosi differenziale la quale oltre ad un’accurata anamnesi, deve essere supportata dalle prove di produzione delle lacrime e della saliva, e dagli esami immunologici Questo iter diagnostico in realtà è generalmente effettuato in modo non conforme al protocollo AECG e spesso non completo,con il risultato di sottostimare l’incidenza della SS e questo può giustificare il fatto che,allo stato attuale la sindrome di Sjogren è considerata una malattia “RARA”.La Sindrome di Sjögren, è così non inserita nei LEA e nel Registro Nazionale delle malattie rare, sebbene più grave di tante altre malattie rare ivi classificate.. Alle problematiche della malattia va aggiunto il disagio e la sofferenza dei malati per i quali non ci sono farmaci curativi e, l’uso di parafarmaci, farmaci di fascia C, terapie riabilitative fisiche e cure odontoiatriche sono a carico del paziente. La possibilità di una diagnosi certa ,si basa dunque nel rispetto di protocolli ampiamente accettati come quello dell’ American ,(AEGC) , (6),riportato in tabella 1 ,che prevede il riconoscimento di sintomi e segni oculari ed orali ,nonché positività ad un eventuale esame istopatologico (biopsia delle salivari minori), e/o al test di interessamento ghiandolare,con ricerca di anticorpi anti-Ro(SSA),o anti-La(SSB), nel siero . Lo scopo di questo studio è di dimostrare che questo iter diagnostico ,che in Italia spesso non è seguito, può essere di fatto reso praticabile in ambito territoriale, instaurando una procedura d’interazione tra lo specialista oculista, e quello otorinolaringoiatra, che generalmente sono presenti nello stesso giorno nella medesima struttura. Ambulatoriale. Il problema della mancanza del laboratorio di Analisi Cliniche che deve effettuare gli esami sierologici,può essere superato affidando la ricerca degli autoanticorpi allo stesso specialista ORL, con l’impiego di un test rapido come quello dell’Immuno –Blot, eseguito,non sul siero ma sulla saliva subito dopo l’esame del flusso salivare. Con questo studio intendiamo quindi verificare, come del resto espresso chiaramente dal (AEGC), la possibilità di diagnosticare la Sindrome di Sjögren ambulatorialmente in tutti i pazienti che all’anamnesi presentino sintomatologia sospetta almeno per la presenza di un sintomo “secco”.e nel contempo ricavare i dati della prevalenza per il campione sotto esame.
Esempi per La sindrome di Sjogren primaria (pSS), o sindrome Sicca(1), è una malattia infiammatoria cronica, caratterizzata da secchezza degli occhi (xeroftalmia) e della bocca (xerostomia), a patogenesi autoimmune, dovuta a una riduzione della secrezione delle ghiandole lacrimali e salivari.. La SS può anche essere secondaria, in associazione ad altre patologie autoimmuni come l’artrite reumatoide, il lupus eritematoso sistemico e la sclerosi sistemica progressiva. La pSS può accompagnarsi a un’infiltrazione linfocitaria di differenti organi e tessuti e può portare a nefrite e/o polmonite interstiziale ed è associata ad un aumentato rischio di sviluppare patologie linfoproliferative. L’eziopatogenesi della pSS è ancora tutta da chiarire e probabilmente multifattoriale ovvero, genetica e ambientale. L’importanza dei fattori genetici è confermata dall’associazione tra pSS e alcuni fenotipi del HLA (2),in particolare :nella regione D sottoregione DR,codificanti antigeni HLA di classe 2,ovvero: • DRW52 • DR3: forma associata ad anticorpi anti-SSA e -SSB • DR4: forma associata ad artrite reumatoide Recentemente sempre più studi evidenziano gli aspetti genetici, principalmente con il lavoro svolto dal team che è stato in grado di identificare sei nuovi geni probabilmente associati alla SS.Il team internazionale di ricercatori fa parte del progetto SGENE ed ha identificato questi geni correlati alla malattia (3.) ,che sono: • IRF5 e STAT4 che sono “regolatori master” che attivano le cellule durante una risposta immunitaria • CXCR5 controlla il turn-over dei linfociti e può aiutare a spiegare il motivo per cui le cellule immunitarie bersaglio ghiandole produttrici di umidità. • TNIP1 è un partner di legame con un altro gene di codifica di autoimmunità correlato alla malattia, TNFAIP3, che “taglia” i meccanismi di autoregolazione sul sistema immunitario. • IL12A è una sub-unità di una proteina che agisce come un messaggero tra le cellule e modula le risposte immunitarie. • BLK è un gene a cellule B, che potrebbe spiegare l’aumento del numero di anticorpi La netta prevalenza del sesso femminile, (9:1),può essere verosimilmente attribuita all’influenza degli estrogeni (4), che aumentano l’attivazione policlonale dei linfociti B e la formazione di autoanticorpi,attivando il sistema immunitario. Vi sono molti studi in merito alla correlazione fra SS e infezioni; in particolare il Citomegalovirus (CMV) e il virus di Epstein Barr (EBV) (5), sono considerati possibili induttori della malattia. Questi virus hanno, infatti, un facile accesso (tropismo) alle ghiandole salivari e potrebbero innescare le reazioni autoimmuni verso le stesse, sia con un meccanismo di attivazione aspecifica policlonale B linfocitaria sia con un meccanismo di mimetismo molecolare, cioè inducendo una risposta autoimmunitaria verso antigeni virali capace però di coinvolgere anche strutture self ,appartenenti cioè all’organismo(5).Per quanto riguarda la Pagina 3 patogenesi, la SS è caratterizzata da un’espansione policlonale dei linfociti B (un’attivazione dei linfociti di tipo B) e da un’ipergammaglobulinemia con presenza di autoanticorpi. Gli autoanticorpi mediano il danno alle ghiandole lacrimali provocando la distruzione del dotto secretorio mentre a livello delle salivari provocano un ingrossamento dei dotti escretori con successiva atrofia e distruzione della ghiandola stessa. Alterazioni analoghe possono verificarsi a livello di tutte le ghiandole dell’organismo con conseguente secchezza della cute, della vulva, dell’albero bronchiale, della gola e della mucosa nasale. La sensazione di secchezza oculare e salivare è comunque comune tra la popolazione e può avere cause diverse dalla pSS come l’infezione da virus dell’epatite, quella da HIV, l’amiloidosi, la sarcoidosi, la sclerosi multipla. Inoltre interferenze metaboliche causate da alcuni farmaci, diuretici, antiipertensivi, antidepressivi, abuso di alcool, droghe e stress, possono provocare quadri sintomatologici sovrapponibili a quelli della SS, rendendo difficile una diagnosi differenziale la quale oltre ad un’accurata anamnesi, deve essere supportata dalle prove di produzione delle lacrime e della saliva, e dagli esami immunologici Questo iter diagnostico in realtà è generalmente effettuato in modo non conforme al protocollo AECG e spesso non completo,con il risultato di sottostimare l’incidenza della SS e questo può giustificare il fatto che,allo stato attuale la sindrome di Sjogren è considerata una malattia “RARA”.La Sindrome di Sjögren, è così non inserita nei LEA e nel Registro Nazionale delle malattie rare, sebbene più grave di tante altre malattie rare ivi classificate.. Alle problematiche della malattia va aggiunto il disagio e la sofferenza dei malati per i quali non ci sono farmaci curativi e, l’uso di parafarmaci, farmaci di fascia C, terapie riabilitative fisiche e cure odontoiatriche sono a carico del paziente. La possibilità di una diagnosi certa ,si basa dunque nel rispetto di protocolli ampiamente accettati come quello dell’ American ,(AEGC) , (6),riportato in tabella 1 ,che prevede il riconoscimento di sintomi e segni oculari ed orali ,nonché positività ad un eventuale esame istopatologico (biopsia delle salivari minori), e/o al test di interessamento ghiandolare,con ricerca di anticorpi anti-Ro(SSA),o anti-La(SSB), nel siero . Lo scopo di questo studio è di dimostrare che questo iter diagnostico ,che in Italia spesso non è seguito, può essere di fatto reso praticabile in ambito territoriale, instaurando una procedura d’interazione tra lo specialista oculista, e quello otorinolaringoiatra, che generalmente sono presenti nello stesso giorno nella medesima struttura. Ambulatoriale. Il problema della mancanza del laboratorio di Analisi Cliniche che deve effettuare gli esami sierologici,può essere superato affidando la ricerca degli autoanticorpi allo stesso specialista ORL, con l’impiego di un test rapido come quello dell’Immuno –Blot, eseguito,non sul siero ma sulla saliva subito dopo l’esame del flusso salivare. Con questo studio intendiamo quindi verificare, come del resto espresso chiaramente dal (AEGC), la possibilità di diagnosticare la Sindrome di Sjögren ambulatorialmente in tutti i pazienti che all’anamnesi presentino sintomatologia sospetta almeno per la presenza di un sintomo “secco”.e nel contempo ricavare i dati della prevalenza per il campione sotto esame.
Vedi anche
Traduzioni di La sindrome di Sjogren primaria (pSS), o sindrome Sicca(1), è una malattia infiammatoria cronica, caratterizzata da secchezza degli occhi (xeroftalmia) e della bocca (xerostomia), a patogenesi autoimmune, dovuta a una riduzione della secrezione delle ghiandole lacrimali e salivari.. La SS può anche essere secondaria, in associazione ad altre patologie autoimmuni come l’artrite reumatoide, il lupus eritematoso sistemico e la sclerosi sistemica progressiva. La pSS può accompagnarsi a un’infiltrazione linfocitaria di differenti organi e tessuti e può portare a nefrite e/o polmonite interstiziale ed è associata ad un aumentato rischio di sviluppare patologie linfoproliferative. L’eziopatogenesi della pSS è ancora tutta da chiarire e probabilmente multifattoriale ovvero, genetica e ambientale. L’importanza dei fattori genetici è confermata dall’associazione tra pSS e alcuni fenotipi del HLA (2),in particolare :nella regione D sottoregione DR,codificanti antigeni HLA di classe 2,ovvero: • DRW52 • DR3: forma associata ad anticorpi anti-SSA e -SSB • DR4: forma associata ad artrite reumatoide Recentemente sempre più studi evidenziano gli aspetti genetici, principalmente con il lavoro svolto dal team che è stato in grado di identificare sei nuovi geni probabilmente associati alla SS.Il team internazionale di ricercatori fa parte del progetto SGENE ed ha identificato questi geni correlati alla malattia (3.) ,che sono: • IRF5 e STAT4 che sono “regolatori master” che attivano le cellule durante una risposta immunitaria • CXCR5 controlla il turn-over dei linfociti e può aiutare a spiegare il motivo per cui le cellule immunitarie bersaglio ghiandole produttrici di umidità. • TNIP1 è un partner di legame con un altro gene di codifica di autoimmunità correlato alla malattia, TNFAIP3, che “taglia” i meccanismi di autoregolazione sul sistema immunitario. • IL12A è una sub-unità di una proteina che agisce come un messaggero tra le cellule e modula le risposte immunitarie. • BLK è un gene a cellule B, che potrebbe spiegare l’aumento del numero di anticorpi La netta prevalenza del sesso femminile, (9:1),può essere verosimilmente attribuita all’influenza degli estrogeni (4), che aumentano l’attivazione policlonale dei linfociti B e la formazione di autoanticorpi,attivando il sistema immunitario. Vi sono molti studi in merito alla correlazione fra SS e infezioni; in particolare il Citomegalovirus (CMV) e il virus di Epstein Barr (EBV) (5), sono considerati possibili induttori della malattia. Questi virus hanno, infatti, un facile accesso (tropismo) alle ghiandole salivari e potrebbero innescare le reazioni autoimmuni verso le stesse, sia con un meccanismo di attivazione aspecifica policlonale B linfocitaria sia con un meccanismo di mimetismo molecolare, cioè inducendo una risposta autoimmunitaria verso antigeni virali capace però di coinvolgere anche strutture self ,appartenenti cioè all’organismo(5).Per quanto riguarda la Pagina 3 patogenesi, la SS è caratterizzata da un’espansione policlonale dei linfociti B (un’attivazione dei linfociti di tipo B) e da un’ipergammaglobulinemia con presenza di autoanticorpi. Gli autoanticorpi mediano il danno alle ghiandole lacrimali provocando la distruzione del dotto secretorio mentre a livello delle salivari provocano un ingrossamento dei dotti escretori con successiva atrofia e distruzione della ghiandola stessa. Alterazioni analoghe possono verificarsi a livello di tutte le ghiandole dell’organismo con conseguente secchezza della cute, della vulva, dell’albero bronchiale, della gola e della mucosa nasale. La sensazione di secchezza oculare e salivare è comunque comune tra la popolazione e può avere cause diverse dalla pSS come l’infezione da virus dell’epatite, quella da HIV, l’amiloidosi, la sarcoidosi, la sclerosi multipla. Inoltre interferenze metaboliche causate da alcuni farmaci, diuretici, antiipertensivi, antidepressivi, abuso di alcool, droghe e stress, possono provocare quadri sintomatologici sovrapponibili a quelli della SS, rendendo difficile una diagnosi differenziale la quale oltre ad un’accurata anamnesi, deve essere supportata dalle prove di produzione delle lacrime e della saliva, e dagli esami immunologici Questo iter diagnostico in realtà è generalmente effettuato in modo non conforme al protocollo AECG e spesso non completo,con il risultato di sottostimare l’incidenza della SS e questo può giustificare il fatto che,allo stato attuale la sindrome di Sjogren è considerata una malattia “RARA”.La Sindrome di Sjögren, è così non inserita nei LEA e nel Registro Nazionale delle malattie rare, sebbene più grave di tante altre malattie rare ivi classificate.. Alle problematiche della malattia va aggiunto il disagio e la sofferenza dei malati per i quali non ci sono farmaci curativi e, l’uso di parafarmaci, farmaci di fascia C, terapie riabilitative fisiche e cure odontoiatriche sono a carico del paziente. La possibilità di una diagnosi certa ,si basa dunque nel rispetto di protocolli ampiamente accettati come quello dell’ American ,(AEGC) , (6),riportato in tabella 1 ,che prevede il riconoscimento di sintomi e segni oculari ed orali ,nonché positività ad un eventuale esame istopatologico (biopsia delle salivari minori), e/o al test di interessamento ghiandolare,con ricerca di anticorpi anti-Ro(SSA),o anti-La(SSB), nel siero . Lo scopo di questo studio è di dimostrare che questo iter diagnostico ,che in Italia spesso non è seguito, può essere di fatto reso praticabile in ambito territoriale, instaurando una procedura d’interazione tra lo specialista oculista, e quello otorinolaringoiatra, che generalmente sono presenti nello stesso giorno nella medesima struttura. Ambulatoriale. Il problema della mancanza del laboratorio di Analisi Cliniche che deve effettuare gli esami sierologici,può essere superato affidando la ricerca degli autoanticorpi allo stesso specialista ORL, con l’impiego di un test rapido come quello dell’Immuno –Blot, eseguito,non sul siero ma sulla saliva subito dopo l’esame del flusso salivare. Con questo studio intendiamo quindi verificare, come del resto espresso chiaramente dal (AEGC), la possibilità di diagnosticare la Sindrome di Sjögren ambulatorialmente in tutti i pazienti che all’anamnesi presentino sintomatologia sospetta almeno per la presenza di un sintomo “secco”.e nel contempo ricavare i dati della prevalenza per il campione sotto esame.
Materials and Methods
Were examined twenty patients who visit the ORL regardless of the condition for which they were presented, they presented a medical history and symptoms consistent with a possible presence of a syndrome of Sjogren. Su of them have been carried out the test to determine the salivary flow and the collected sample was examined for the presence of ANA / ENA The patients were later sent to a specialist eye doctor.
Measure the unstimulated salivary flow, with saliva collection test tube graduated: – — reference value of positive: ? 1.5 ml.
– eye examination, collection history data related to ocular symptoms and execution of the Schirmer test.
– implementation of the Schirmer test; reference value for positivity: ? 5mm in 5 minutes.
– examine and search of anti -Ro (SSA), and / or anti -The (SSB), the saliva sample resulting from the measurement of salivary flow, by Immuno-Blot technique performed with the kit of AESKU DIAGNOSTIC, distributed by GRIFOLS ITALY *
– immune-Blot Assay .Principle of the test method and modified for use on human saliva.
The antigens are fixed in parallel lines on a nitrocellulose membrane. The membrane is stabilized to avoid non-specific reactions, and the strips with the specific antigens fixed in well defined positions, are incubated with the sample of saliva as such (1 ml). The antibodies of the subject if present in the sample will bind to the antigen. The unbound fraction is eliminated by washing in the next stage and then the anti-human immunoglobulin conjugated with horseradish peroxidase (conjugate) are incubated and react with the antigen-antibody complex sample. The Unbound conjugate is then removed by washing in which following the addition of the TMB substrate that causes an enzymatic reaction that converts it into a precipitate blue tinge.
RESULTS
During a period of about six months he has been made a screening of medical history type of approximately 4000 patients in eye examination and / or ENT clinics structures ICP territorial With question wording anamnestic times the recognition of the possible presence of the main oral and ocular symptoms as expressed by the protocol established by the American-European Consensus Group, have been identified on twenty patients on which to carry out the Schirmer test, the test of salivary flow and finally the research of antibodies in saliva using the method Immuno –Blot.
This screening procedure allows for the end of the tests confirm the presence or absence of Sjogren’s syndrome In accordance with the protocol, which see table 1, requires that they be met for a positive pSS some of the following conditions:
a) the presence of at least four of the six criteria, provided that in them the criterion is positive or histopathological or one serological; in our case the salivary.
b) the presence of at least three of the four objective criteria and that is, between III, IV, V, VI.
A preliminary reading of the medical history of admission of patients see Table 2, you can point out to them the following information:
a) prevalence of female = 90%
b) oral prevalent symptom, dry mouth = 90%
c) oral predominant symptom: dry and / or ocular discomfort 70%
From Table 3 are deduced also prevalence’s of objective signs
a) Sign oral test flow positive in 60% of cases
b) Sign eye Schirmer test positive in 50% of cases
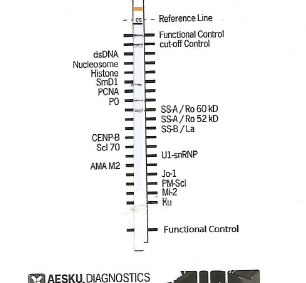
The results in Table 3 indicate that in five patients is positive research SSA auto antibodies. For two of them ,in which there are only anti-red, see figure, you can establish a diagnosis of primary SS according to the criteria AECG, while two patients had a secondary SS, (see images 2 and 4). In Table 3 it notes that a case presents in saliva, a positive Histones, (picture 3), on account of other autoimmune diseases, probably LES. A sixth patient (number .15) is a positive test of salivary flow and anti -Ro (SSA), but in accordance with the protocol established AECG not be definitively established in the territorial diagnosis of pSS, so It was sent histopathology analysis that confirmed the presence of primary SS. The diagnosis of pSS patients testing positive was confirmed later with the execution of the serological tests that confirmed the presence of antibodies, in addition to their title the result indicates a sensitivity of the Protocol equal to 80%. Data obtained also indicate that the sample examined in this study syndrome (pSS) has a head value 7.5, as people with every 10,000 inhabitants .This value is, one and half times greater than that specified in the most reliable sources at European level, taking into account studies using criteria classification born of the same document used in this research, namely that relating to the American-European consensus. Data from many studies agree in estimating the prevalence of primary Sjögren’s syndrome in Europe amounted to a value of 1 for every 2,567 people. According to Italian law not to be considered rare prevalence must be higher than 0.05%, or one in every 2,500 people.
DISCUSSION
The diagnosis of SS is typically obtained after a diagnostic procedure quite complex, the patient complaint some disorders, sometimes referred to only as feelings not well specified especially in the time and therefore not properly classifiable as required by the Protocol AECG. In addition, the doctor will often tend to overlook some of these disorders misled during anamnesis by other confounding factors such as taking medication, stress, consumption and / or abuse of alcohol and cigarettes.
The proposal, which is the basis of following the study, provided for a precise and strict protocol for the following diagnostic steps to be performed in the outpatient setting:
a) History in acceptance otolaryngologist and / or eye care, regardless of its purpose, to search for any oral symptoms and eye, according to the protocol AECG.
b) In positive response to at least two of the parameters identified in the protocol, such as dry mouth and / or eye, are routinely performed the Schirmer test and a test flow.
c) On the basis of these results, and being in the outpatient setting, and then not being able to perform histopathological tests, to have a confirmation of the presence of a pSS, it must be carried out the detection of antibodies anti-Ro (SSA), anti-La ( SSA), in the saliva of the patient with the method of Immuno Blot. This test is being sold by manufacturers to be used on serum and is not expected to his utilization for investigations on human saliva. This limit is rightly placed, because saliva by its nature has many advantages diagnostic, such as non-invasiveness, easy collection, and the relative stability of the sample differently from that serum, obtained by plasma, requires retention after centrifugation to ± 20³Cfino analyzed. The limit of saliva is generally due to the concentration of anaboliti to search that is much lower than in serum (7). In particular, this essay Immuno Blot research serum ANA and ENA concentration of which are in the saliva thousand times lower (8), see table. 4) In this study it was hypothesized to be able to use this method, according to recent studies on the composition of salivary immunoglobulins and in particular those on the concentration of anti-Ro (SSA), and anti-La (SSA), (9.) As you can see from the table (5), concentrations in saliva and serum Ig are very similar and the results of the study also observed a significant statistical correlation, this work also shows that the pSS increases levels of immunoglobulin in the plasma but, proportionally more in saliva. The assumptions that may justify such concentrations are essentially two and that is that there is a transfer of proteins from blood vessels spraying the tissues of the salivary glands, but more likely as recent studies have shown, (10), (11), for a over production of Ig in response to an inflammatory process. This research has shown results really indicative and correlated to the literature cited: in fact been detected in five samples bands of complex / conjugate autoantibody-Ro (SSA), very evident and the same intensity of the control line, (see images 1 and 2). In addition to confirmation of the hypothesis of increased production in the SS primary, but also in the secondary one, of the various components of Ig, other bands are detected, as can be observed from the image 2, (SMD1 + anti-red), in 3 (Histones), and finally in the fourth (SMD1 + PO + anti-red). This type of analysis allowed to do so also a diagnosis of secondary SS confirmed by serological, upon inspection Immuno Blot test it was evaluated in this study, referring to the intensity of the bands, visually, but it is possible to quantify the concentration of auto antibodies with the use of a simple scanner and determining the exact title within the stated range. Outside of the territorial structures were made for serological confirmation of results obtained with the saliva test. With the benchmark values of standard laboratory accepted for titles ANA and ENA, the results of the analysis confirmed the diagnosis detected in this study. In this context ,it can be said that the determination of the securities is unnecessary for research and proposal of this work being the purpose of the proposal is to make a diagnosis of pSS, regardless of the stage of disease activity, because it is not absolutely correlated with the title of the various auto antibodies. Infact, the value that is given to the result of the ENA is by convention indicative of a positivity more or less marked, are an exception, but this case does not fall within the scope of this study, the values of anti1-RNP, which if detected at high titer , are specific markers for mixed connective tissue. In the case of a detection of auto antibodies to SSA, these fluctuate over time, not disappearing during remission of the disease. In each case taking into account that according to this study, which has as its ultimate goal only a proper diagnosis of pSS, and not the state of his business, just remember that repeat testing research in the saliva of the ENA, can reasonably be taken into account only in the case of a secondary Sjogren’s syndrome to verify a modification of the clinical picture, since at present antibodies, one can add other positivity of ENA. Finally ,regarding persons definitely found positive to pSS, according to the criteria AECG, and four in number, in 7000 persons visited, or eight out of 10,000, according to the criteria established by the European Union the SS could not be considered a rare disease, at least second the data from this study The EU in fact, defines a disease as rare when the number of cases present in a given population does not exceed 0.05%, in other words a person every 2000. Given that in Italy there are just over 16 thousand People who suffer from pSS ascertained, from the point of view purely numerical, this disease should be defined as rare. In fact, the data of this study are related to a segment of the population ,which have not been visited in virtually visited young people under the age of twenty, although the incidence among them is very low (? 5%). In any case the quote taken must nevertheless be taken into strong consideration.
Conclusions
The problem of diagnosis of pSS has been addressed in this preliminary search not only for the purely biomedical, in accordance with the protocol AECG, but also for the logistical and temporal. The patient within the same structure, belonging to “Surgeries Territorial ICP” in Milan, has had in a single day the answer to a question very important diagnostic of a disease that in some cases could be only latent. Certainly this kind of integrated approach, should be re-evaluated and enhanced skills within the same structure, including nursing that are essential especially in the research phase of auto antibodies with the method Immuno Blot. The last and not least observation concerns, the value of prevalence found in this study, approximately one and a half higher than projected in other works, and that raises the question, where is confirmed in other experiments, if still the syndrome pSS can be considered a rare disease, that does not exceed the percentage dello0.05%, or one person every 2,000 inhabitants.
BIBLIOGRAFIA
1) Organizzazione Italiana di Reumatologia; www.Reumatologia.Org.Patologia/05.it
2) Bolstad I A,Jonsson R.Genetic Aspects Of Sjögren’s Syndrome .Arthritis Res 2002, 4:353-359
3) Jessard L C,He Li,Adrianto I,John A Ice,Rasmussen A,et al.Variants at multiple loci implicated in both innate and adaptive immune responses are associated with Sjogren syndrome ,Nature Genetics 2014;Nov,45(11):1284-92
4) Hayashi Y,Arakaki R Ishima.Apoptosis and estrogen deficiency in primary Sjogren Syndrome Curr Opin Rheumatol. 2004 Sep;16(5):522-6
5)Sjogren Syndrome .Anne V Miller 2010, Chief Editor: Herbert S Diamond, MD.Diamond MD
6)Vitali C1, Bombardieri S, Jonsson R, Moutsopoulos HM, Alexander EL, Carsons SE, Daniels TE, Fox PC, Fox RI, Kassan SS, Pillemer SR, Talal N, Weisman MH; European Study Group On Classification Criteria For Sjögren’s Syndrome.Classification Criteria For Sjögren’s Syndrome: A Revised Version Of The European Criteria Proposed By The American-European Consensus Group. Ann Rheum Dis. 2002 Jun;61(6):554-
7) Pink R1, Simek J, Vondrakova J, Faber E, Michl P, Pazdera J, Indrak K Saliva As A Diagnostic Medium Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub. 2009 Jun;153(2):103-10.
8)Haga HJ1, Hulten B, Bolstad AI, Ulvestad E, Jonsson Reliability And Sensitivity Of Diagnostic Tests For Primary Sjögren’s Syndrome.See comment in PubMed Commons belowJ Rheumatol. 1999 Mar;26(3):604-8.
9) A.-K. Halse, M.C. Marthinussen, M. Wahren-Herlenius, And R. Jonssonscand Isotype Distribution Of Anti-Ro/SS-A And Anti-La/SS-B Antibodies In Plasma And Saliva Of Patients With Sjoè Gren’s Syndromej Rheumatol 2000;29:13
10) Ben-Chetrit E, Fischel R, Rubinow A. Anti-SSA/Ro And Anti-SSB/La Antibodies In Serum And Saliva Of Patients Withsjogren’s Syndrome. Clin Rheumatol 1993;12:471 ± 4.
11) Busamia B1, Gonzales-Moles MA, Mazzeo M, Linares J, Demarchi M, Gobbi C, Albiero E, Finkelberg A.Assessing The Determination Of Salivary Electrolytes And Anti-Ro And Anti-La Antibodies For The Diagnosis Of Sjögren’s Syndrome (SS).See comment in PubMed Commons belowMed Oral Patol Oral Cir Bucal. 2010 May 1;15(3):E437-40.
TABLES
Inizio modulo
Table 1. Diagnostic criteria of the American-European Consensus Group in SS
I. Ocular symptoms: a positive response to at least one of the following questions:
1. Dry and ocular discomfort and persistent daily for a period exceeding three months
2. Feeling recurrent sand in the eyes and foreign body
3. Use of artificial tears more than three times a day
II. Oral symptoms: a positive response to at least one of the following questions:
1. Feeling of dry mouth daily for a period exceeding three months
2. parotid swelling recurrent or persistent
3. Use of liquids for ingestion of dry foods
III. Ocular signs: positive to at least one of the following tests:
1. Schirmer test (<5 mm in 5 minutes)
2. Test the Rose Bengal (score> 4 : by Von Bijservedl)
IV. Histopathology: Exhibit of focal lymphocytic sialadenitis in biopsy minor salivary glands obtained from an apparently normal mucosa and, with a focus score 1, defined as the number of foci of lymphocytes adjacent to the berries of apparently normal mucosa and containing more than 50 lymphocytes per 4mm2 of glandular tissue
V. Salivary glands: salivary gland involvement documented by the positivity of at least one of the following tests:
1. scintigraphy of the salivary glands
2. Sialography parotid
3. Measurement of unstimulated salivary flow (1,5 ml in 15 minutes)
VI. Autoantibodies: presence in the serum of the following antibodies: anti-Ro (SSA) and / or anti-La (SSB)
For primary Sjögren’s syndrome
In patients with no other pathology potentially associated, the primary SS may be defined as:
a) The presence of at least 4 of the 6 criteria is indicative of primary SS, provided they are satisfied theV criteria (histopathology) or VI (serology).
b.) Presence of at least three of the four objective criteria (ie, III, IV, V, VI)
For secondary Sjögren’s syndrome
In patients with a potentially associated disease (for example another tissue disease
connective), the presence of I or II of the criterion, plus at least two of the criteria III, IV and V, can be indicative of secondary Sjögren’s.
TABLE 2. SCRENING EVALUATION FOR ORAL AND EYES SYMPTOMS
In the absence of a history of external factors as other drugs
| Pz | ORAL
DRYENESS |
PAROTID
SWELLING |
use liquid intake for dry foods | dry eye discomfort | Sensation sand in eye |
Use of tears artificia |
| 1F | + | – | + | + | – | – |
| 2F | + | – | + | + | + | – |
| 3F | + | + | + | + | + | – |
| 4F | + | – | + | + | – | – |
| 5F | + | – | – | – | – | – |
| 6F | + | – | + | + | + | – |
| 7F | + | – | + | + | + | – |
| 8M | + | – | + | + | + | – |
| 9F | + | – | + | + | + | – |
| 10F | + | + | + | + | – | – |
| 11F | + | – | + | – | – | – |
| 12M | + | – | – | – | – | – |
| 13F | – | – | + | – | – | – |
| 14F | + | – | + | – | – | – |
| 15F | + | – | – | + | + | – |
| 16F | – | – | + | – | – | – |
| 17F | + | .- | + | + | – | – |
| 18F | + | – | – | + | + | – |
| 19F | + | – | – | + | – | – |
| 20F | + | – | – | + | + | – |
| 21 M + – + + + – |
| 22F + – + + + – |
| 23M + – – + – – |
| 24 F – – – + – – |
| 25F – – – + + – |
Legend
(+) = THIS SYMPTOM (-) SYMPTOM ABSENT ; (?) Autoantibodies presence)
KEY (+) SCHIRMER TEST ? 5mm / 15 minutes (+) TEST SALIVARY FLOW S?1.5 ml/ 15 minu
TABLE 3 TEST RESULTS SCHIRMER; SALIVA TEST FLOW -RESEARCH ANTIBODIES ANA / ENA
| PATIENT | SCHIRMER
TEST |
FLOW TEST | Anti-Ro(SSA) | Anti –La (SSA) | OTHER
ANA /ENA |
| 1F | + | + | + | – | -. |
| 2F | + | + | + | – | – |
| 3F | + | + | – | – | – |
| 4F | + | + | – | – | . |
| 5F | + | + | + | – | SmD1 PO- |
| 6F | + | + | + | – | SmD1 |
| 7F | + | + | – | – | HISTONES |
| 8 M | + | + | – | – | |
| 9F | – | + | – | – | – |
| 10F | – | + | – | – | – |
| 11F | + | – | – | – | |
| 12M | – | + | – | – | |
| 13F | – | – | – | — | |
| 14F | – | – | – | – | |
| 15F | – | + | + | – | |
| 16F | – | + | – | – | |
| 17F | – | – | – | – | |
| 18F | – | – | – | – | |
| 19F | – | – | – | – | |
| 20F | + | – | – | – |
| 21M + + ? – – |
| 22F – + – – – |
| 23M + – – – – |
| 24F + + ? – – |
| 25F + + – – – |
Legend
(+) = THIE PRESENCE OF THE SYMPTOM (-) SYMPTOM ABSENT ;
Table 4. Processing of data on the concentrations (mg / l) of immunoglobulins in plasma and the saliva of the patients with SS, derived from the work of Halse K-A9, and Ben-Chetrit10
| Total Ig Plasma Saliva | ||||
|
Table 5. Processing of the data of the literature 9, 10,11 for the values of Ro 52 kD, 60 kD Ro, La and 48 kD IgG, IgA, and IgM isotypes in plasma and saliva of patients with SS The results are expressed as antigen antibody speci®c kU / mg total immunoglobulin isotype. The values refer to comparison p-value according to the Wilcoxon test between antibody levels in plasma and saliva
|
Ro 52kD Ro 60 kD La 48 kD |
| Plasma Saliva Plasma Saliva Plasma Saliva |
| IgG |
| Range 2 – 6973 0 – 6468 0 – 540 0 – 309 1 – 2634 0 – 4878 |
| Average (SD) 2258 (2517) 1689 (2087) 76 (148) 54 (91) 414 (705) 781 (1187) |
| median 1061 913 5 5 105 518 |
| p value 0.01 0.39 0.57 |
| IgA |
| Range 1 351 0 -439 2 – 72 0 – 330 1 – 2921 0 7578 |
| Average(SD) 73 (91) 134 (156) 18 (26) 70 (113) 323 (705) 898 (1798) |
| median 57 63 5 22 77 208 |
| p value 0.30 0.20 0.001 |
| IgM |
| Range 10 -824 0 – 1162 6 – 104 0 – 451 2 – 1588 0 – 2797 |
| Average(SD) 165 (218) 316 (389) 29 (25) 63 (117) 356 (484) 529 (839) |
| median 60 156 20 0 117 232 |
| p value 0.047 0.96 0.51 |
IMAGE 1

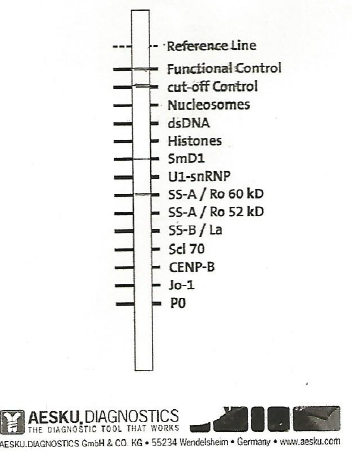
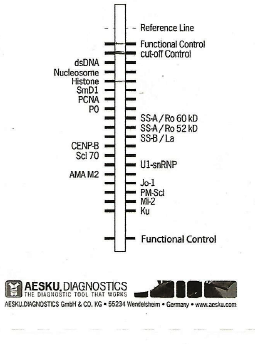
IMAGE 4