Applicazione topica di mitomicina C in seguito a rimozione endoscopica di un papilloma invertito nasosinusale
Matteo Chiarlone, Elena Piumetto1 , Giovanni Guzzo1 , Ester Cravero1, Lucia Bagnasco2, Anna Morello2, Carlo Brunetti2, Toni Pazzaia1
1 Struttura complessa di Otorinolaringoiatria, Ospedale SS.Annunziata , Savigliano, Cuneo, Italia
2 Farmacia Ospedaliera – Ospedale SS.Annunziata , Savigliano, Cuneo, Italia
Contatti:
Matteo Chiarlone
Struttura complessa di Otorinolaringoiatria, Ospedale SS.Annunziata , Via Ospedali 9, 12038 Savigliano, Cuneo, Italy
Tel. +39 0172719368
E-mail: matteo.chiarlone@aslcn1.it
Riassunto
Il papilloma invertito nasosinusale (IP), descritto per la prima volta nel 1854, è una lesione epiteliale benigna della cavità nasale e dei seni paranasali, composta da epitelio respiratorio colonnare o ciliato ben differenziato con differenziazione squamosa variabile. L’incidenza del papilloma invertito è stata segnalata tra 0,2 e 0,7 casi per 100.000 abitanti all’anno e comprende dallo 0,5 al 4% dei tumori nasali primari. Le sedi maggiormente coinvolte, in ordine decrescente, sono: parete nasale laterale, cellule etmoidali, seno mascellare e, meno frequentemente, seni frontali e sfenoidali e setto nasale. La chirurgia è la prima scelta nel trattamento del papilloma invertito. Questo studio mirava a valutare l’efficacia della mitomicina nel ridurre il volume del papilloma invertito per sottoporsi ad un approccio chirurgico meno invasivo al fine di ridurre il rischio di complicanze intra e post operatorie.
Parole chiave
Papilloma invertito naso sinusale (IP), chirurgia endoscopica del seno, mitomicina C, recidiva
Introduzione
L’Organizzazione Mondiale della Sanità (OMS) definisce il papilloma invertito nasosinusale come una lesione epiteliale benigna composta da epitelio respiratorio colonnare o ciliato ben differenziato con differenziazione squamosa variabile. (1)
L’OMS classifica l’IP come un sottogruppo dei papillomi schneideriani. Con il termine papilloma invertito si descrive l’aspetto istologico dell’epitelio, cioè invertito nello stroma, con una membrana basale distinta ed intatta che separa e definisce la componente epiteliale dal sottostante stroma connettivale. (2)
L’incidenza dell’IP è stata segnalata tra 0,2 e 0,7 casi per 100.000 abitanti all’anno (3). I papillomi invertiti comprendono dallo 0,5 al 4% dei tumori nasali primari. (4) Non esiste una predilezione del sito e i casi bilaterali sono riscontrati nel 4,9% dei pazienti. Il rapporto maschi/femmine è 7:1 (5) con una prevalenza maggiore nella razza caucasica. Il picco di età di presentazione è tra la quinta e la sesta decade (età media 53 anni);
Le sedi nasali più frequentemente interessate dal papilloma invertito, in ordine di prevalenza decrescente, sono: parete nasale laterale, cellule etmoidali, seno mascellare e, meno spesso, seni frontali e sfenoidali e setto nasale. (6) Il papilloma invertito con origine mediale (dal setto o dai turbinati) comprende il 34% dei casi segnalati; quella che ha origine lateralmente (dai seni e dalla parete nasale laterale) costituisce il resto (66 %).(7) La parete nasale laterale rappresenta la sede più comune di origine, mentre abbastanza frequentemente i seni paranasali risultano interessati per estensione. (8) Tuttavia, in alcuni casi è stato segnalato un coinvolgimento isolato dello sfenoide con papilloma invertito. (8-9)
Le principali caratteristiche che lo distinguono dagli altri tumori nasosinusali sono: relativa aggressività locale, alti tassi di recidiva, sia precoce che tardiva, e possibile associazione con carcinoma, diagnosticato inizialmente o in recidiva.
L’eziologia dell’IP rimane per lo più sconosciuta. Sono state suggerite alcune ipotesi, ma non è mai stata stabilita la causalità per i fattori sospetti: fumo, allergie o determinate esposizioni professionali (10). La recidiva e il potenziale carcinomatoso hanno suggerito per molti anni l’origine virale. È stata studiata un’implicazione del virus Epstein-Barr (EBV), ma in modo non conclusivo (11). Per più di 30 anni si sospetta che il virus del papilloma umano (HPV) svolga un ruolo importante nella fisiopatologia dell’IP, ma i dati della letteratura rimangono contraddittori (12).
I sintomi clinici non specifici dell’IP possono includere occlusione unilaterale, rinorrea, infezione dei seni e iposmia/anosmia. Tali manifestazioni primarie possono essere accompagnate da mal di testa e dolore/pressione facciale, lacrimazione o disturbi della vista (13). Endoscopicamente, la lesione appare come una superficie grigiastra
massa polipoide con superficie multinodulare.(14) Il trattamento di scelta è chirurgico; l’approccio endonasale puramente endoscopico o l’approccio combinato endoscopico ed esterno è ormai divenuto il gold standard per molti autori.(15) La chemioterapia e/o la radioterapia possono seguire all’intervento chirurgico in caso di trasformazione maligna; molti autori hanno suggerito che la radioterapia potrebbe essere utilizzata nei pazienti il cui tumore non è stato completamente asportato o in caso di recidive multiple.(16)
La mitomicina è derivata dallo Streptomyces caespitosus e possiede attività antineoplastica simile a quella degli agenti alchilanti. La mitomicina inibisce selettivamente la sintesi del DNA provocando legami crociati, degrada il DNA preformato e provoca la lisi nucleare e la formazione di cellule giganti. Ad alte concentrazioni, anche l’RNA cellulare e la sintesi proteica possono essere soppressi. La mitomicina non è specifica per la fase del ciclo cellulare, sebbene abbia il suo effetto massimo nelle fasi S tardive e iniziali. Viene utilizzato per via endovenosa per trattare i tumori del tratto gastrointestinale superiore; tuttavia il suo utilizzo più comune è topico. Sia le applicazioni umane che quelle animali confermano la sicurezza dell’uso topico della mitomicina-C (17,18)
Ha molti usi topici da parte degli otorinolaringoiatri nella chirurgia endoscopica del seno, (19) atresia delle coane, (20) laringea, (21) e chirurgia tracheale (22) per ridurre al minimo o addirittura prevenire sinechie e stenosi postoperatorie.
Lo scopo di questo studio era di valutare l’efficacia della mitomicina nel ridurre l’entità della recidiva dell’IP dopo approccio endoscopico endonasale.
Materiali e metodi
Nel gennaio 2020 una donna di 52 anni, senza comorbidità, è stata sottoposta a visita otorinolaringoiatrica per sintomi sinusali: ostruzione nasale unilaterale, rinorrea anteriore e/o posteriore e iposmia. L’esame clinico mediante esplorazione endoscopica rileva, nella cavità nasale sinistra, una neoformazione lobulata di colore grigio-rossastro, più consistente di un classico polipo infiammatorio.
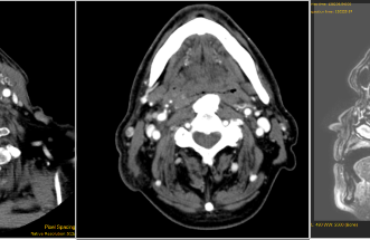
La paziente è stata sottoposta RM come complemento alla TC.
Successivamente è stata eseguita la biopsia endoscopica con la diagnosi istologica di papilloma invertito pT3 (secondo la classificazione di Krouse).
Secondo i dati della letteratura, un papilloma invertito pT3 (secondo la classificazione di Krouse) esteso fino alla parete anteriore del seno mascellare richiederebbe un trattamento chirurgico estensivamente demolitivo in grado di esporre ampiamente il seno mascellare fino alla sua parete anteriore.
In questi casi viene generalmente proposta una maxillectomia mediana di tipo III (chiamata anche intervento di “Sturmann-Canfield” in cui la maxillectomia viene allargata anteriormente per includere il dotto nasolacrimale fino all’esposizione dell’incisura piriforme).
Alla paziente è stato proposto questo tipo di intervento chirurgico e sono stati spiegati i rischi e le complicanze legate all’intervento: l’approccio chirurgico è stato rifiutato.
Dopo un ampio colloquio informativo con la paziente e dopo l’autorizzazione del comitato etico locale, si è deciso di procedere con medicazioni locali con Mitomicina al 5% una volta al mese per 6 mesi.
Pertanto, a partire da ottobre 2020, la paziente è stata sottoposta a medicazioni locali sotto guida endoscopica in anestesia locale: durante le medicazioni, previa anestesia locale, è stata posizionata la garza orlata a livello della cavità mascellare sinistra che successivamente è stata imbevuta con Mitomicina al 5%. La medicazione è stata lasciata in sede per 30 minuti e poi rimossa.
Questa medicazione è stata ripetuta a novembre 2020, dicembre 2020 e gennaio 2021.
Al controllo endoscopico di gennaio 2021 si è riscontrata una netta riduzione dell’area iperplastica riportata ad ottobre 2020. Pertanto, in accordo con la paziente, si è deciso di praticare altre due medicazioni (febbraio 2021 e marzo 2021) e di valutare, successivamente, l’intervento di revisione endoscopica che, in considerazione della riduzione volumetrica della lesione, risulterà sicuramente meno invasivo di quanto previsto all’inizio.
Nel nostro caso, in seguito al trattamento chemioterapico topico con mitomicina, abbiamo ottenuto un completo riassorbimento del PI a livello della parete anteriore e del processo zigomatico. Pertanto abbiamo deciso di programmare una maxillectomia mediana di tipo II con preservazione del dotto nasolacromale. Per dominare più facilmente la parete anteriore del seno mascellare sinistro, abbiamo allargato la maxillectomia anteriormente mantenendoci sotto la valvola Hasner, preservando il dotto nasolacrimale: questo ci ha permesso di eseguire un’agevole sinusoscopia mascellare anche a livello della parete anteriore grazie all’utilizzo di un’ottica da 70°.
Contrariamente a quanto appariva dall’indagine radiologica eseguita prima del trattamento con mitomicina, abbiamo riscontrato un’assenza di coinvolgimento della parete mascellare anteriore da parte dell’IP.
Pertanto, avendo osservato un PI limitato alle pareti posteriore e mediale, abbiamo deciso di non eseguire una maxillectomia di tipo III. Inoltre, poiché la neoformazione si estendeva al terzo anteriore del meato medio, abbiamo eseguito una resezione subtotale della prima porzione del turbinato medio, un’uncinectomia totale con apertura delle precamere frontali e apertura della bulla etmoidale. Abbiamo eseguito l’apertura della seconda porzione del turbinato medio e successiva etmoidectomia posteriore (tempo chirurgico 120 minuti)
Abbiamo anche ridotto notevolmente il rischio di complicanze postoperatorie rispetto a una maxillectomia di tipo III
Il decorso postoperatorio è stato regolare e privo di problematiche. La paziente è stata sottoposta a controlli periodici (mensili) per circa 6 mesi. Durante i controlli è stata eseguita un’endoscopia nasale in anestesia locale. Durante i controlli non sono stati riscontrati segni di recidiva della malattia.
Discussione
Il trattamento principale dell’IP è la chirurgia e la pietra portante del successo dell’intervento è l’exeresi radicale della lesione.
Tuttavia esiste un elevato rischio di recidiva soprattutto per lesioni localizzate in aree difficilmente controllabili con l’approccio chirurgico endoscopico.
Nel presente studio abbiamo utilizzato l’applicazione MMC per ridurre il volume della lesione e ridurre al minimo l’effetto morboso dell’approccio endoscopico transnasale.
La mitomicina-C (MMC) ha anche molti usi topici in otorinolaringoiatria. È stato utilizzato in modo sicuro per ridurre le sinechie e le stenosi nasali dopo un intervento chirurgico endoscopico sui seni (10) e l’atresia delle coane (11).
L’eziopatogenesi dell’IP non è ancora ben compresa, ma questo effetto della MMC nel ridurre al minimo il volume dell’IP potrebbe essere attribuito al fatto che la MMC è un agente chemioterapico che inibisce la sintesi del DNA e quindi inibisce la migrazione cellulare e la mitosi diminuendo il tasso di proliferazione cellulare.
La MMC è stata applicata in modo semplice e sicuro, senza alcun rischio aggiuntivo per i pazienti; nel caso clinico con il suo utilizzo non sono state segnalate granulazioni, croste, infezioni o sanguinamenti.
La tecnica si è rivelata sicura, affidabile, facilmente applicabile ed efficace.
In particolare, abbiamo dimostrato come l’uso della mitomicina fosse utile per ridurre il volume della lesione e rendere meno invasivo il successivo trattamento chirurgico endoscopico.
Conclusioni
L’applicazione topica della MMC nel papilloma invertito nasosinusale è sicura ed efficace nel ridurre il volume della lesione e pianificare trattamenti chirurgici endoscopici meno invasivi al fine di ridurre le complicanze intra e post-operatorie.
Dichiarazione di conflitto di interessi
Gli autori dichiarano assenza di conflitto di interesse.
Finanziamento
Questa ricerca non ha ricevuto alcun finanziamento specifico da parte di enti finanziatori del settore pubblico, commerciale o no-profit.
Contributi dell’autore
MC, EP hanno eseguito la preparazione del manoscritto; Il EP e la CE hanno eseguito le modifiche e le revisioni finali; LB, AM, CB hanno letto e approvato la versione presentata.
References
- Eggers G, Mühling J, Hassfeld S. Inverted papilloma of paranasal sinuses. J Craniomaxillofac Surg 2007 Jan;35(1):21-9. https://doi.org/10.1016/j.jcms.2006.10.003
- Mirza S, Bradley PJ, Acharya A, Stacey M, Jones NS. Sinonasal inverted papillomas: recurrence, and synchronous and metachronous malignancy. J Laryngol Otol. 2007 Sep;121(9):857-64. https://doi: 10.1017/S002221510700624X
- Buchwald C, Franzmann MB, Tos M. Sinonasal papillomas: a report of 82 cases in Copenhagen County, including a longitudinal epidemiological and clinical study. Laryngoscope. 1995 Jan;105(1):72-9. https://doi: 10.1288/00005537-199501000-00016
- Lane AP, Bolger WE. Endoscopic management of inverted papilloma. Curr Opin Otolaryngol Head Neck Surg. 2006 Feb;14(1):14-8. https://doi: 10.1097/01.moo.0000193175.54450.1f
- Lesperance MM, Esclamado RM. Squamous cell carcinoma arising in inverted papilloma. Laryngoscope. 1995 Feb;105(2):178-83. https://doi: 10.1288/00005537-199502000-00013
- Krouse JH. Endoscopic treatment of inverted papilloma: safety and efficacy. Am J Otolaryngol. 2001 Mar-Apr;22(2):87-99. https://doi: 10.1053/ajot.2001.22563
- Lee TJ, Huang CC, Chen YW, et al. Medially originated inverted papilloma. Otolaryngol Head Neck Surg. 2009 Mar;140(3):324-9. https://doi: 10.1016/j.otohns.2008.10.037.
- Yiotakis I, Psarommatis I, Manolopoulos L, et al. Isolated inverted papilloma of the sphenoid sinus. J Laryngol Otol. 2001 Mar;115(3):227-30. https://doi: 10.1258/0022215011907046.
- Fakhri S, Citardi MJ, Wolfe S, et al. Challenges in the management of sphenoid inverted papilloma. Am J Rhinol. 2005 Mar-Apr;19(2):207-13. Erratum in: Am J Rhinol. 2005 Jul-Aug;19(4):422.
- Barnes L, Eveson J, Reichart P, et al. World Health Organization Classification of Tumours. Pathology and genetics of head and neck tumours IARC Press, Lyon (2005)
- Buchwald C, Franzmann MB, Tos M. Sinonasal papillomas: a report of 82 cases in Copenhagen County, including a longitudinal epidemiological and clinical study. Laryngoscope. 1995 Jan;105(1):72-9. https://doi: 10.1288/00005537-199501000-00016.
- Syrjänen K, Syrjänen S. Detection of human papillomavirus in sinonasal papillomas: systematic review and meta-analysis. Laryngoscope. 2013 Jan;123(1):181-92. https://doi: 10.1002/lary.23688.
- Lesperance MM, Esclamado RM. Squamous cell carcinoma arising in inverted papilloma. Laryngoscope. 1995 Feb;105(2):178-83. https://doi: 10.1288/00005537-199502000-00013.
- Wang MJ, Noel JE. Etiology of sinonasal inverted papilloma: A narrative review. World J Otorhinolaryngol Head Neck Surg. 2016 Dec 21;3(1):54-58. https://doi: 10.1016/j.wjorl.2016.11.004.
- Peng R, Thamboo A, Choby G, et al. Outcomes of sinonasal inverted papilloma resection by surgical approach: an updated systematic review and meta-analysis. Int Forum Allergy Rhinol. 2019 Jun;9(6):573-581. https://doi: 10.1002/alr.22305.
- Miyazaki T, Haku Y, Yoshizawa A, et al. Clinical features of nasal and sinonasal inverted papilloma associated with malignancy. Auris Nasus Larynx. 2018 Oct;45(5):1014-1019. https://doi: 10.1016/j.anl.2018.02.009.
- Warner D, Brietzke SE. Mitomycin C and airway surgery: how well does it work? Otolaryngol Head Neck Surg. 2008 Jun;138(6):700-9. https://doi: 10.1016/j.otohns.2008.02.011.
- Crosara PF, Vasconcelos AC, Guimarães RE, Becker HM, Becker CG, Crosara SL, Nascimento E. Effect of mitomycin C on the secretion of granulocyte macrophages colonies stimulating factor and interleukin-5 in eosinophilic nasal polyps stromal culture. Braz J Otorhinolaryngol. 2005 Jul-Aug;71(4):459-63. https://doi: 10.1016/s1808-8694(15)31199-x..
- Konstantinidis I, Tsakiropoulou E, Vital I, et al. Intra- and postoperative application of Mitomycin C in the middle meatus reduces adhesions and antrostomy stenosis after FESS. Rhinology. 2008 Jun;46(2):107-11.
- Carter JM, Lawlor C, Guarisco JL. The efficacy of mitomycin and stenting in choanal atresia repair: a 20 year experience. Int J Pediatr Otorhinolaryngol. 2014 Feb;78(2):307-11. https://doi: 10.1016/j.ijporl.2013.11.031.
- Hueman EM, Simpson CB. Airway complications from topical mitomycin C. Otolaryngol Head Neck Surg. 2005 Dec;133(6):831-5. https://doi: 10.1016/j.otohns.2005.07.031.
- Reichert LK, Zhao AS, Galati LT, et al. The Efficacy of Mitomycin C in the Treatment of Laryngotracheal Stenosis: Results and Experiences with a Difficult Disease Entity. ORL J Otorhinolaryngol Relat Spec. 2015;77(6):351-8. https://doi: 10.1159/000439174. Epub 2015 Oct 10.